
【题目】某研究小组为了探究固体甲(含两种元素)和固体乙(无机矿物盐,含五种元素)的组成和性质,设计并完成了如下实验:

已知:向溶液1中连续滴加盐酸,先产生白色沉淀,后沉淀溶解;向溶液2中连续通入气体2,也是先产生白色沉淀,后沉淀溶解。请回答下列问题:
(1)甲的化学式____________,乙的化学式______________。
(2)加热条件下,气体1与固体2反应,产物中有一种气体和一种固体,该反应的化学方程式为__________________。
(3)气体2与足量溶液1反应的离子方程式为____________________。
【答案】Al4C3 BaCO3·Cu(OH)2或BaCu(OH)2CO3 4CuO+CH4=4Cu+CO2+2H2或8CuO+ CH4 =4Cu2O+CO2+2H2O 或3CuO+CH4=3Cu+CO+2H2O 或 6CuO+ CH4 = 3Cu2O+CO+2H2O CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
【解析】
根据转化关系图中物质间的转化关系和物质的状态,根据原子守恒计算分析物质的组成;根据反应物的性质及题给信息中生成物的性质分析书写相关反应方程式。
(1)甲和NaOH溶液反应生成气体1,气体1是含氢量最高的烃,为CH4,根据元素守恒知甲中含有C元素,甲烷的物质的量为0.15mol,根据C原子守恒得m(C)=0.15mol×12g/mol=1.8g,甲是二元化合物,另一种元素质量为7.2g-1.8g=5.4g,向溶液1中连续滴加盐酸,先产生白色沉淀,后沉淀溶解,则溶液1为偏铝酸盐,根据元素守恒知,甲为碳铝化合物,则n(Al)=![]() =0.2mol,C、Al原子个数之比=0.15mol:0.2 mol=3:4,则甲为Al4C3;偏铝酸钠和气体2反应生成白色沉淀b为Al(OH)3,气体2为酸性气体;固体2和稀盐酸反应生成蓝色溶液,固体2中含有Cu元素;固体1和溶液a混合得到溶液2和固体2,溶液2能溶解氢氧化铝,向溶液2中连续通入气体2,先产生白色沉淀,后沉淀溶解,则溶液2为强碱溶液,溶液2只能是Ba(OH)2;固体1和液体a混合得到溶液2,则a为H2O,且固体1中含有BaO,固体1为氧化物,所以还含有Cu O;根据质量守恒得气体2质量=29.5g-1.8g-23.3g=4.4g,且气体2为无色无味气体,向氢氧化钡溶液中通入气休2先生成白色沉淀后白色沉淀溶解,则气体2为CO2,n(CO2)=
=0.2mol,C、Al原子个数之比=0.15mol:0.2 mol=3:4,则甲为Al4C3;偏铝酸钠和气体2反应生成白色沉淀b为Al(OH)3,气体2为酸性气体;固体2和稀盐酸反应生成蓝色溶液,固体2中含有Cu元素;固体1和溶液a混合得到溶液2和固体2,溶液2能溶解氢氧化铝,向溶液2中连续通入气体2,先产生白色沉淀,后沉淀溶解,则溶液2为强碱溶液,溶液2只能是Ba(OH)2;固体1和液体a混合得到溶液2,则a为H2O,且固体1中含有BaO,固体1为氧化物,所以还含有Cu O;根据质量守恒得气体2质量=29.5g-1.8g-23.3g=4.4g,且气体2为无色无味气体,向氢氧化钡溶液中通入气休2先生成白色沉淀后白色沉淀溶解,则气体2为CO2,n(CO2)=![]() ,n(CuO)=
,n(CuO)=![]() ,n(BaO)=
,n(BaO)=![]() ,n(H2O)=
,n(H2O)=![]() ,根据原子守恒计算乙中Ba、Cu、H、O、C原子个数比为1:1:2:5:1,则其化学式为: BaCO3·Cu(OH)2或BaCu(OH)2CO3,故答案为:Al4C3;BaCO3·Cu(OH)2或BaCu(OH)2CO3;
,根据原子守恒计算乙中Ba、Cu、H、O、C原子个数比为1:1:2:5:1,则其化学式为: BaCO3·Cu(OH)2或BaCu(OH)2CO3,故答案为:Al4C3;BaCO3·Cu(OH)2或BaCu(OH)2CO3;
(2)根据上述分析,气体1为CH4,固体2为 CuO,加热条件下,气体1与固体2反应,产物中有一种气体和一种固体,根据原子守恒及化合价变化守恒分析该反应的化学方程式可能为4CuO+CH4=4Cu+CO2+2H2或8CuO+ CH4 =4Cu2O+CO2+2H2O 或3CuO+CH4=3Cu+CO+2H2O 或 6CuO+ CH4 = 3Cu2O+CO+2H2O,故答案为:4CuO+CH4=4Cu+CO2+2H2或8CuO+ CH4 =4Cu2O+CO2+2H2O 或3CuO+CH4=3Cu+CO+2H2O 或 6CuO+ CH4 = 3Cu2O+CO+2H2O;
(3)二氧化碳与偏铝酸钠溶液反应的离子方程式为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
,故答案为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-。


科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)是印染工业的一种常用原料,又称保险粉,是一种白色粉末,易溶于水,但不溶于乙醇,在碱性介质中稳定。
(1)Na2S2O4中S元素的化合价为____。
(2)连二亚硫酸钠在潮湿空气中极不稳定,易分解并引起燃烧,甚至发生爆炸,反应的化学方程式为:2Na2S2O4=Na2S2O3+Na2SO3+___。保存“保险粉”时常加入少量Na2CO3固体,目的是___。
(3)Na2S2O4暴露于空气中易吸收氧气和水蒸气而变质,当氧化剂和还原剂的物质的量之比为1:2时,反应产物的化学式为____。
(4)工业上可用如图装置电解NaHSO3和NaC1溶液制Na2S2O4。总反应为:2NaHSO3+2NaC1![]() Na2S2O4+2NaOH+C12↑
Na2S2O4+2NaOH+C12↑

①惰性电极a连接电源的____(填“正极”或“负极”),其电极反应式为____;
②若不加隔膜,则连二亚硫酸钠产率降低,其原因是____。
向银离子的乙二胺四乙酸(EDTA)配合物溶液中,滴加用NaOH碱化的连二亚硫酸钠溶液可生成纳米级银粉,该方法能用来测定Na2S2O4纯度,其反应原理可简单表示为:2Ag++S2O42-+4OH-=2Ag↓+2SO32-+2H2O。现取5.000g粗产品用上述方法测定纯度,将制得纳米级银过滤、洗涤、干燥、称量,其质量为4.320g。计算粗产品中连二亚硫酸钠的质量分数为____。测得连二亚硫酸钠的纯度比实际值小,若排除实验过程中的操作误差,分析可能的原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢分解制取氢气和硫黄的反应原理为2H2S(g)![]() S2(g)+2H2(g),在2.0 L恒容密闭容器中充入0.1 mol H2S,不同温度下测得H2S的转化率与时间的关系如图所示。下列说法不正确的是
S2(g)+2H2(g),在2.0 L恒容密闭容器中充入0.1 mol H2S,不同温度下测得H2S的转化率与时间的关系如图所示。下列说法不正确的是
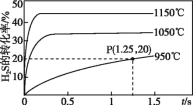
A.正反应为吸热反应
B.图中P点:v正>v逆
C.950 ℃时,0~1.25 s生成H2的平均反应速率为0.008 mol·L-1·s-1
D.950 ℃时,该反应的平衡常数的值小于3.125×10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及硼的化合物有着广泛的用途。请回答下列问题:
(1)硼酸(H3BO3)在水中电离出阴离子B(OH)4-,请试着写出硼酸的电离方程式___________。
(2)已知:H3BO3的电离常数Ka=5.8×1010,H2S的电离常数掏Ka1=5.7×108、Ka2=1.2×1015,向饱和硼酸溶液中滴加0.1 mol·L1 Na2S溶液,写出发生反应的离子方程式_________。
(3)BCl3主要用作半导体硅的掺杂源,遇水强烈水解,0.01mol BCl3溶于300mL蒸馏水中(溶液体积变化忽略不计),则所得溶液的pH值约为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰乙酸乙酯是有机合成中非常重要的原料,实验室制备乙酰乙酸乙酯的反应原理、装置示意图和有关数据如下所示:


实验步骤:
Ⅰ.合成:向三颈烧瓶中加入9.8ml无水乙酸乙酯,迅速加入0.1g切细的金属钠。水浴加热反应液,缓慢回流约2h至金属钠全部反应完。停止加热,冷却后向反应混合物中加入50%乙酸至反应液呈弱酸性。
Ⅱ.分离与提纯:
①向反应混合物中加入等体积的饱和食盐水,分离得到有机层。
②水层用5mL无水乙酸乙酯萃取,分液。
③将①②所得有机层合并,洗涤、干燥、蒸馏得到乙酰乙酸乙酯粗产品。
④蒸馏粗产品得到乙酰乙酸乙酯3.9g。
(1)球形冷凝管中冷却水从______(填“上”或“下”)口进入,上方干燥管中盛无水CaCl2,其作用是________。
(2)实验室制备乙酰乙酸乙酯时,通常在无水乙酸乙酯中加入微量的无水乙醇,其作用是___。
(3)分离与提纯操作①中使用的分离仪器是________。加入饱和食盐水的作用是 _______。
(4)分离与提纯操作③用饱和NaHCO3溶液洗涤的目的是 _______。
(5)本实验的产率为_______ %(结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年3月,我国科学家研发出一种新型的锌碘单液流电池,其原理如图所示。下列说法不正确的是
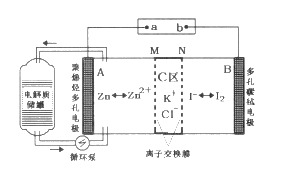
A. 放电时B电极反应式为:I2+2e-=2I-
B. 放电时电解质储罐中离子总浓度增大
C. M为阳离子交换膜,N为阴离子交换膜
D. 充电时,A极增重65g时,C区增加离子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环保、安全的铝—空气电池的工作原理如下图所示,下列有关叙述错误的是

A. NaCl的作用是增强溶液的导电性
B. 正极的电极反应式为: O2+4e-+2H2O=4OH-
C. 电池工作过程中,电解质溶液的pH不断增大
D. 用该电池做电源电解KI溶液制取1molKIO3,消耗铝电极的质量为54g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种染料敏化太阳能电池的示意图。电池的一个电极由有机光敏染料(S)涂覆在TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为:
TiO2/S→TiO2/S*(激发态)
TiO2/S*→TiO2/S*+e-
I3-+2e-→3I-
2TiO2/S++3I-→2TiO2/S+I3-

下列关于该电池叙述错误的是
A. 电池工作时,是将太阳能转化为电能
B. 电池工作时,I-离子在镀铂导电玻璃电极上放电
C. 电池中镀铂导电玻璃为正极
D. 电池的电解质溶液中I-和I3-的浓度不会减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g),已知下列化学键的键能:
2NH3(g),已知下列化学键的键能:

下列说法正确的是( )
A.该反应为吸热反应
B.该反应中反应物的总能量高于生成物的总能量
C.反应热ΔH=92 kJ·mol-1
D.生成1 mol NH3放出92 kJ热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com