
| 1000ρw% |
| M |
| N |
| NA |
| m |
| n |
| n |
| V |
| 18g |
| 1000g/L |
1000×1.2×
| ||||||
| 36.5 |
| 6.02×1022 |
| 6.02×1023mol-1 |
| 6.4g |
| 0.1mol |
| 0.5mol |
| 0.25L |


科目:高中化学 来源: 题型:
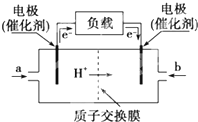 如图是某公司批量生产的笔记本电脑所用的甲醇燃料电池的构造示意图.甲醇在催化剂作用下提供质子(H+)和电子,电子经过电路、质子经内电路到达另一极与氧气反应,该电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列有关该电池的说法错误的是( )
如图是某公司批量生产的笔记本电脑所用的甲醇燃料电池的构造示意图.甲醇在催化剂作用下提供质子(H+)和电子,电子经过电路、质子经内电路到达另一极与氧气反应,该电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列有关该电池的说法错误的是( )| A、右边的电极为电池的负极,b处通入的是空气 |
| B、左边的电极为电池的负极,a处通入的是甲醇 |
| C、电池负极的反应式为:2CH3OH+2H2O-12e-═2CO2↑+12H+ |
| D、电池正极的反应式为:3O2+12H++12e-═6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、C+O2
| ||||
B、CH4+2O2
| ||||
| C、CaO+H2O=Ca(OH)2 | ||||
D、CuO+H2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com