
| A. | 卤素单质Cl2、Br2、I2的氧化性强弱 | |
| B. | 气态氢化物NH3、H2O、HF的稳定性 | |
| C. | 碱金属单质Li、Na、K与水反应的剧烈程度 | |
| D. | 1mol Na、Mg、Al分别与足量盐酸反应时失电子数的多少 |
分析 A.元素非金属性越强,其单质的氧化性越强;
B.元素非金属性越强,其气态氢化物的稳定性越强;
C.元素金属性越强,其单质与水反应越剧烈;
D.金属性强弱与失电子难易程度有关.
解答 解:A.元素非金属性越强,其单质的氧化性越强,非金属性Cl>Br>I,所以卤素单质Cl2、Br2、I2的氧化性依次减弱,故A正确;
B.元素非金属性越强,其气态氢化物的稳定性越强,非金属性F>O>N,所以氢化物NH3、H2O、HF的稳定性依次增强,故B正确;
C.元素金属性越强,其单质与水反应越剧烈,金属性由弱到强顺序是Li、Na、K,所以与水剧烈程度由弱到强顺序是Li<Na<K,故C正确;
D.金属性强弱与失电子难易程度有关,与失电子多少无关,故D错误;
故选D.
点评 本题考查金属性、非金属性强弱顺序,为高频考点,明确金属性、非金属性强弱判断方法是解本题关键,注意:1.金属性非金属性强弱与得失电子多少无关,与得失电子难易程度有关;
2.非金属性强弱与氢化物的稳定性有关,与氢化物的熔沸点高低无关.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 某温度下,水的离子积常数Kw=10-13,在此温度下,将pH=12的NaOH溶液Va L与pH=2的硫酸Vb L混合,所得溶液呈中性,则Va:Vb=1:10 | |
| B. | 已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为Ka•Kh=Kw | |
| C. | 常温下,pH=1的强酸溶液,加水稀释后,溶液中各离子浓度均降低 | |
| D. | 甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向煮沸的1 mol/L NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体 | |
| B. | 乙烯能被高锰酸钾氧化,利用此反应可鉴别乙烷和乙烯 | |
| C. | 实验室通常用加热分解NH4Cl固体的方法制取氨气 | |
| D. | 直接观察某盐溶液的焰色反应为黄色,则该溶液中一定不含钾元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
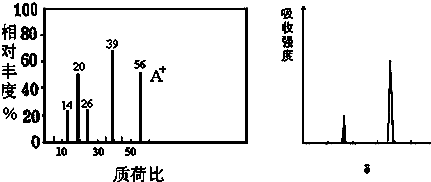
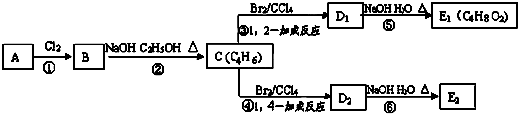
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| X | SO2 | Cl2 | NH3 | SO2 |
| Y | H2S | CO2 | CO2 | Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com