
| A. | 0.3mol | B. | 0.4mol | C. | 0.5mol | D. | 0.6mol |
分析 Cu元素化合价由0价升高为+2价,每个Cu原子失2个电子,得失电子守恒,由Na守恒可知n(NaOH)=n(NO)+n(NO2)+2n(N2O4),据此混合气体中NO的物质的量.
解答 解:Cu元素化合价由0价升高为+2价,每个Cu原子失2个电子;另一个是HNO3→NaNO2,N元素由+5价降低为+3价,每个N原子得2个电子,51.2gCu共失电子为$\frac{51.2g}{64g/mol}$×2=1.6mol,共转移电子的物质的量为:1.6mol×2=3.2mol,所以得失电子守恒3n(NO)+n(NO2)+2n(N2O4)=3.2mol,由Na守恒可知n(NaOH)=n(NO)+n(NO2)+2n(N2O4)=0.5L×2mol/L=1mol,而混合物共0.9mol,所以n(NO)+n(NO2)+n(N2O4)=0.9mol,解之得n(NO)=0.3mol,故选:A.
点评 本题考查氧化还原反应的有关计算,难度中等,用得失电子和组成之比守恒是解题的关键.


科目:高中化学 来源: 题型:解答题
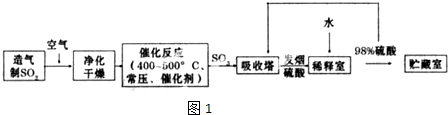
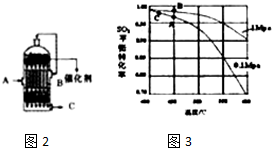
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
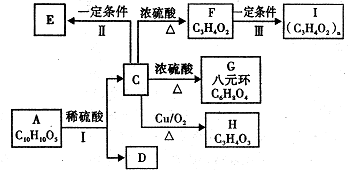
 ,反应Ⅲ的化学方程式为
,反应Ⅲ的化学方程式为 .
.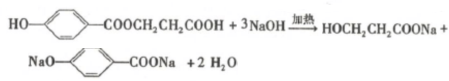 .
.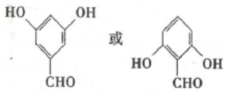 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
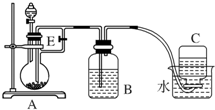 如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化.实验提供的试剂:铁屑、6mol/L硫酸溶液、NaOH溶液.下列说法错误的是( )
如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化.实验提供的试剂:铁屑、6mol/L硫酸溶液、NaOH溶液.下列说法错误的是( )| A. | B中盛有一定量的NaOH溶液,A中应预先加入的试剂是铁屑 | |
| B. | 实验开始时应先将活塞E关闭 | |
| C. | 生成Fe(OH)2的操作为:关闭E,使A中溶液压入B瓶中 | |
| D. | 取下装置B中的橡皮塞,使空气进入,有关反应的化学方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于12.5% | B. | 大于12.5% | C. | 小于12.5% | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
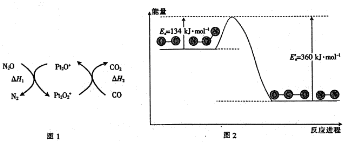
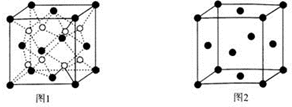
| A. | 由图1可知:△H1=△H+△H2 | |
| B. | 由图2可知△H=-226 kJ/mol | |
| C. | 为了实现转化需不断向反应器中补充Pt2O+和Pt2O2+ | |
| D. | 由图2可知该反应正反应的活化能大于逆反应的活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
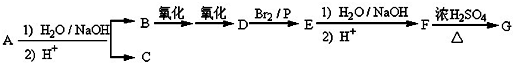

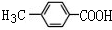 .
.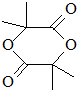 .
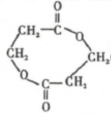
.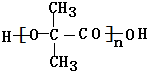 +(n-1)H2O,该反应属于缩聚反应(填反应类型).
+(n-1)H2O,该反应属于缩聚反应(填反应类型).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com