
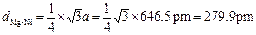
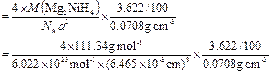
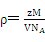 ,求得晶体的密度,乘于氢的质量分数求得储氢密度,最后与液氢的密度相比,求该材料的储氢能力。
,求得晶体的密度,乘于氢的质量分数求得储氢密度,最后与液氢的密度相比,求该材料的储氢能力。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
 HBr+HIO,下列有关IBr的叙述中,错误的是( )?
HBr+HIO,下列有关IBr的叙述中,错误的是( )?| A.固体IBr是分子晶体? |
| B.在很多反应中IBr是强氧化剂? |
| C.IBr跟水反应时,它既是氧化剂又是还原剂? |
| D.跟NaOH溶液反应生成NaBr和NaIO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:判断题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
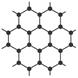
| A.10个 | B.18个 | C.24个 | D.14个 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
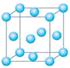
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com