
| A£® | øĆĪĀ¶ČĻĀCH3COOHµÄµēĄėĘ½ŗā³£ŹżŌ¼ĪŖ1.8”Į10-5 | |
| B£® | µć¢Ł“¦ČÜŅŗÖŠc£ØCH3COO-£©£¼c£ØCH3COOH£© | |
| C£® | µć¢Ū“¦ČÜŅŗÖŠc£ØOH-£©=c£ØCH3COOH£©+c£ØH+£© | |
| D£® | µĪ¶Ø¹ż³ĢÖŠ²»æÉÄܳöĻÖ£ŗc£ØCH3COOH£©£¾c£ØCH3COO-£©£¾c£ØOH-£©£¾c£ØNa+£©£¾c£ØH+£© |
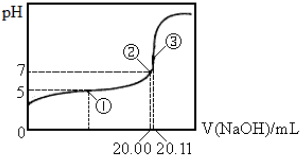
·ÖĪö ŌŚµć¢Ū“¦Ē”ŗĆÖŠŗĶ£¬·“Ӧɜ³É“×ĖįÄĘ£¬øł¾ŻÖŹ×ÓŹŲŗćæÉµĆ£ŗc£ØOH-£©=c£ØCH3COOH£©+c£ØH+£©£¬ŌČÜŅŗÖŠ“×ĖįµÄÅضČĪŖ£ŗ$\frac{0.1000mol/L”Į0.02011L}{0.02L}$=0.10055mol/L£¬
A£®Ōņµć¢Ś“¦ČÜŅŗµÄpH=7£¬“ĖŹ±c£ØNa+£©=c£ØCH3COO-£©=$\frac{0.1000mol/L”Į0.02L}{0.02L+0.02L}$=0.05mol/L£¬c£ØH+£©=10-7mol/L£¬“ĖŹ±ČÜŅŗÖŠ“×ĖįµÄÅضČĪŖ£ŗ$\frac{0.10055mol/L}{2}$-0.05mol/L=0.000275mol/L£¬øł¾ŻĘ½ŗā³£Źż±ķ“ļŹ½æɼĘĖć³ö“×ĖįµÄµēĄėĘ½ŗā³£Źż£»
B£®µć¢Ł“¦ČÜŅŗµÄpH=5£¬ĒāĄė×ÓÅضČĪŖc£ØH+£©=10-5mol/L£¬ĒāŃõøłĄė×ÓÅضČĪŖc£ØOH-£©=10-9mol/L£¬ÓÉӌȱɣĒāŃõ»ÆÄĘČÜŅŗĢå»ż£¬ĪŽ·ØÅŠ¶Ļc£ØCH3COO-£©”¢c£ØCH3COOH£©µÄ“󊔣»
C£®µć¢Ū“¦Ē”ŗĆÖŠŗĶ£¬·“Ӧɜ³É“×ĖįÄĘ£¬øł¾ŻÖŹ×ÓŹŲŗćÅŠ¶Ļ£»
D£®øĆ¹ŲĻµĪ„·“ĮĖµēŗÉŹŲŗć£¬ĖłŅŌŌŚµĪ¶Ø¹ż³ĢÖŠ²»æÉÄܳöĻÖ£®
½ā“š ½ā£ŗµć¢Ū“¦Ē”ŗĆÖŠŗĶ£¬·“Ӧɜ³É“×ĖįÄĘ£¬øł¾ŻÖŹ×ÓŹŲŗćæÉµĆ£ŗc£ØOH-£©=c£ØCH3COOH£©+c£ØH+£©£¬ŌČÜŅŗÖŠ“×ĖįµÄÅضČĪŖ£ŗ$\frac{0.1000mol/L”Į0.02011L}{0.02L}$=0.10055mol/L£¬
A£®Ōņµć¢Ś“¦ČÜŅŗµÄpH=7£¬“ĖŹ±c£ØNa+£©=c£ØCH3COO-£©=$\frac{0.1000mol/L”Į0.02L}{0.02L+0.02L}$=0.05mol/L£¬c£ØH+£©=10-7mol/L£¬“ĖŹ±ČÜŅŗÖŠ“×ĖįµÄÅضČĪŖ£ŗ$\frac{0.10055mol/L}{2}$-0.05mol/L=0.000275mol/L£¬ĖłŅŌ“×ĖįµÄµēĄėĘ½ŗā³£ŹżĪŖ£ŗK=$\frac{c£ØC{H}_{3}CO{O}^{-}£©•c£Ø{H}^{+}£©}{c£ØC{H}_{3}COOH£©}$=$\frac{1{0}^{-7}”Į0.02}{0.000275}$”Ö1.8”Į10-5£¬¹ŹAÕżČ·£»
B£®µć¢Ł“¦ČÜŅŗµÄpH=5£¬Ōó¶ūĒāĄė×ÓÅضČĪŖc£ØH+£©=10-5mol/L£¬ÓÉӌȱɣĒāŃõ»ÆÄĘČÜŅŗĢå»ż£¬ŌņĪŽ·ØÅŠ¶Ļ“ĖŹ±c£ØCH3COO-£©”¢c£ØCH3COOH£©µÄ“󊔣¬¹ŹB“ķĪó£»
C£®ŌŚµć¢Ū“¦¶žÕßĒ”ŗĆÖŠŗĶÉś³É“×ĖįÄĘ£¬øł¾ŻÖŹ×ÓŹŲŗćæÉµĆ£ŗc£ØOH-£©=c£ØCH3COOH£©+c£ØH+£©£¬¹ŹCÕżČ·£»
D£®c£ØCH3COOH£©£¾c£ØCH3COO-£©£¾c£ØOH-£©£¾c£ØNa+£©£¾c£ØH+£©ÖŠ£¬øŗµēŗÉ×ÜÅØ¶Č“óÓŚÕżµēŗÉ£¬Ī„·“ĮĖµēŗÉŹŲŗć£¬ĖłŅŌµĪ¶Ø¹ż³ĢÖŠ²»æÉÄܳöĻÖ£¬¹ŹDÕżČ·£»
¹ŹŃ”B£®
µćĘĄ ±¾Ģāæ¼²éĮĖĄė×ÓÅØ¶Č“óŠ”±Č½Ļ£¬ĢāÄæÄѶČÖŠµČ£¬øł¾ŻĶ¼ĻóĆ÷Č·»ģŗĻŅŗÖŠČÜÖŹ×é³ÉĪŖ½ā“š¹Ų¼ü£¬×¢ŅāÕĘĪÕµēŗÉŹŲŗć”¢ĪļĮĻŹŲŗć¼°ÖŹ×ÓŹŲŗćµÄŗ¬Ņ壬ŹŌĢā²ąÖŲæ¼²éѧɜµÄ·ÖĪö”¢Ąķ½āÄÜĮ¦¼°Įé»īÓ¦ÓĆ»ł“”ÖŖŹ¶µÄÄÜĮ¦£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¼ÓČėŅ»ÖÖ·“Ó¦Īļ | B£® | Ōö“óĢåĻµµÄŃ¹Ēæ | C£® | ÉżøßĪĀ¶Č | D£® | Ą©“óČŻĘ÷Ģå»ż |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ·ÖŅŗ”¢ÕōĮó”¢ŻĶČ” | B£® | ŻĶČ””¢Õō·¢”¢·ÖŅŗ | C£® | ·ÖŅŗ”¢ŻĶČ””¢ÕōĮó | D£® | ÕōĮó”¢ŻĶČ””¢·ÖŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 £ØC£©
£ØC£© £ØD£©
£ØD£©
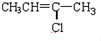 £ØG£©
£ØG£©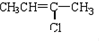 £ØH£©
£ØH£©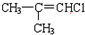
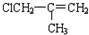 £ØJ£©
£ØJ£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ŌŚĘū³µÉĻ°²×°ČżŠ§“ß»Æ×Ŗ»ÆĘ÷£¬æÉŹ¹Ęū³µĪ²ĘųÖŠµÄÖ÷ŅŖĪŪČ¾Īļ£ØCO”¢NOX”¢Ģ¼Ēā»ÆŗĻĪļ£©½ųŠŠĻą»„·“Ó¦£¬Éś³ÉĪŽ¶¾ĪļÖŹ£¬¼õÉŁĘū³µĪ²ĘųĪŪČ¾£®
ŌŚĘū³µÉĻ°²×°ČżŠ§“ß»Æ×Ŗ»ÆĘ÷£¬æÉŹ¹Ęū³µĪ²ĘųÖŠµÄÖ÷ŅŖĪŪČ¾Īļ£ØCO”¢NOX”¢Ģ¼Ēā»ÆŗĻĪļ£©½ųŠŠĻą»„·“Ó¦£¬Éś³ÉĪŽ¶¾ĪļÖŹ£¬¼õÉŁĘū³µĪ²ĘųĪŪČ¾£®| Ź±¼ä/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c£ØNO£© £Ø”Į10-4mol•L-1£© | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c£ØCO£© £Ø”Į10-3mol•L-1£© | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
| ŹµŃ鱹ŗÅ | T/”ę | NO³õŹ¼ÅضČmol•L-1 | CO³õŹ¼ÅضČmol•L-1 | “߻ƼĮµÄ±Č±ķĆ껿m2•g-1 |
| ¢ń | 280 | 1.2”Į10-3 | 5.8”Į10-3 | 82 |
| ¢ņ | 124 | |||
| ¢ó | 350 | 124 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
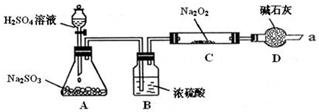

| ŹµŃé²½Öč | ĻÖĻó |
| ¢ŁČ”ÉŁĮæCÖŠ¹ĢĢå²śĪļÓŚŹŌ¹ÜÖŠ£¬¼ÓČėŹŹĮæµÄÕōĮóĖ®Čܽā£® | ¹ĢĢåČ«²æČܽā |
| ¢ŚĻņÉĻŹŌ¹ÜÖŠ¼ÓČė¹żĮæµÄĻ”ŃĪĖį£¬½«²śÉśµÄĘųĢåĶØČėÉŁĮæĖįŠŌKMnO4ČÜŅŗÖŠ£® | KMnO4ČÜŅŗ×ĻÉ«ĶŹČ„ |
| ¢ŪĻņ²½Öč¢Ś·“Ó¦ŗóµÄŹŌ¹ÜÖŠ£¬¼ÓČėŹŹĮæµÄBaCl2ČÜŅŗ£® | ²śÉś°×É«³Įµķ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® |  | B£® |  | ||
| C£® |  | D£® |  |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±½ | B£® | ĖÄĀČ»ÆĢ¼ | C£® | ŅŅĻ© | D£® | ŅŅČ² |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com