
【题目】一定条件下,在水溶液中1molCl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法不正确的是( )

A.这些离子中结合H+能力最强的是B
B.A,B,C,D,E五种微粒中A最稳定
C.C→B+D的反应,反应物的总键能大于生成物的总键能
D.B→A+D是放热反应
【答案】C
【解析】
酸性越弱的酸,其结合氢离子能力越强;能量越低越稳定;C→B+D,根据转移电子守恒得该反应方程式为2ClO2-=ClO3-+ClO-,反应热=(64kJ/mol+60kJ/mol)-2×100kJ/mol=-76kJ/mol,则该反应为放热;B→A+D,根据转移电子守恒得该反应方程式为3ClO-=ClO3-+2Cl-,反应热=(64kJ/mol+2×0kJ/mol)-3×60kJ/mol=-116kJ/mol。
A、酸性越弱的酸,其结合氢离子能力越强,次氯酸是最弱的酸,所以ClO-结合氢离子能力最强为B,故A正确;
B、A、B、C、D、E中A能量最低,所以最稳定,故B正确;
C、C→B+D,根据转移电子守恒得该反应方程式为2ClO2-=ClO3-+ClO-,反应热=(64kJ/mol+60kJ/mol)-2×100kJ/mol=-76kJ/mol,则该反应为放热,所以反应物的总键能小于生成物的总键能,故C错误;
D、B→A+D,根据转移电子守恒得该反应方程式为3ClO-=ClO3-+2Cl-,反应热=(64kJ/mol+2×0kJ/mol)-3×60kJ/mol=-116kJ/mol,为放热反应,故D正确。
答案选C。


科目:高中化学 来源: 题型:
【题目】从明矾[KAl(SO4)2·12H2O]制备Al、K2SO4和H2SO4的流程如下:

明矾焙烧的化学方程式为:4KAl(SO4)2·12H2O+3S![]() 2K2SO4+2Al2O3+9SO2↑+48H2O
2K2SO4+2Al2O3+9SO2↑+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂是_________________。
(2)步骤②中,为提高浸出率,可采取的措施有_____________。
A.粉碎固体混合物 B.降低温度 C.不断搅拌 D.缩短浸泡时间
(3)从水浸后的滤液中得到K2SO4晶体的方法是__________。
(4)步骤③电解的化学方程式是_______________,电解池的电极是用碳素材料做成,电解过程中,阳极材料需要定期更换,原因是:_________。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,则该电池的正极电极反应式是_________________________________。
(6)焙烧a吨明矾(摩尔质量为b g/mol),若SO2的转化率为96%,可生产质量分数为98%的H2SO4质量为______________________吨(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4是中学常见的强氧化剂,用固体碱熔氧化法制备KMnO4的流程和反应原理如图:

反应原理:
反应I:3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
反应Ⅱ:3K2MnO4+2CO2═2KMnO4+MnO2↓+2K2CO3
(墨绿色) (紫红色)
已知25℃物质的溶解度g/100g水
K2CO3 | KHCO3 | KMnO4 |
111 | 33.7 | 6.34 |
请回答:
(1)下列操作或描述正确的是___
A.反应Ⅰ在瓷坩埚中进行,并用玻璃棒搅拌
B.步骤⑥中可用HCl气体代替CO2气体
C.可用玻璃棒沾取溶液于滤纸上,若滤纸上只有紫红色而无绿色痕迹,则反应Ⅱ完全
D.步骤⑦中蒸发浓缩至溶液表面有晶膜出现再冷却结晶:烘干时温度不能过高
(2)___(填“能”或“不能”)通入过量CO2气体,理由是___(用化学方程式和简要文字说明)。
(3)步骤⑦中应用玻璃纤维代替滤纸进行抽滤操作,理由是___。
草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ.称取1.6000g高锰酸钾产品,配成100mL溶液
Ⅱ.准确称取三份0.5025g已烘干的Na2C2O4,置于锥形瓶中,加入少量蒸馏水使其溶解,再加入少量硫酸酸化;
Ⅲ.锥形瓶中溶液加热到75~80℃,趁热用I中配制的高锰酸钾溶液滴定至终点。
记录实验数据如表
实验次数 | 滴定前读数/mL | 滴定后读数/mL |
1 | 2.65 | 22.67 |
2 | 2.60 | 23.00 |
3 | 2.58 | 22.56 |
已知:MnO4﹣+C2O42﹣+H+→Mn2++CO2↑+H2O(未配平)
则KMnO4的纯度为___(保留四位有效数字);若滴定后俯视读数,结果将___(填“偏高”或“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断A(g)+B(g) ![]() C(g)+D(g)是否达到平衡的依据为( )
C(g)+D(g)是否达到平衡的依据为( )
A. 压强不随时间改变
B. 气体的密度不随时间改变
C. c(A)不随时间改变
D. 单位时间里生成C和D的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某容积一定的密闭容器中,可逆反应:A(g)+B(g)![]() xC(g),符合下列图象(Ⅰ)所示关系。由此推断对图(Ⅱ)的正确说法是( )
xC(g),符合下列图象(Ⅰ)所示关系。由此推断对图(Ⅱ)的正确说法是( )
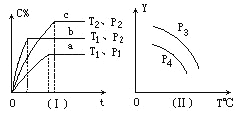
A. P3>P4,Y轴表示A的质量
B. P3<P4,Y轴表示B的百分含量
C. P3>P4,Y轴表示混合气体密度
D. P3>P4,Y轴表示混合气体平均摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 有相同容积的定容密封容器甲和乙,甲中加入
有相同容积的定容密封容器甲和乙,甲中加入![]() 和
和![]() 各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
A.甲、乙提高相同温度 B. 甲中加入0.1mol He,乙不改变
C.甲降低温度,乙不变 D. 甲增加0.1mol ![]() ,乙增加0.1mol I2
,乙增加0.1mol I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究合成氨反应有重要意义,请完成下列探究。
(1)生成氢气:将水蒸气通过红热的炭即产生水煤气。C(s)+H2O(g)![]() H2(g)+CO(g) ΔH=+131.3 kJ·mol-1,ΔS=+133.7 J·mol-1·K-1,该反应在低温下________(“能”或“不能”)自发进行。
H2(g)+CO(g) ΔH=+131.3 kJ·mol-1,ΔS=+133.7 J·mol-1·K-1,该反应在低温下________(“能”或“不能”)自发进行。
(2)已知在400 ℃时,N2(g)+3H2(g)![]() 2NH3(g)的K=0.5。
2NH3(g)的K=0.5。
①在400 ℃时,2NH3(g)![]() N2(g)+3H2(g)的K′=________(填数值)。
N2(g)+3H2(g)的K′=________(填数值)。
②400 ℃时,在0.5 L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2 mol、1 mol、2 mol,则此时反应v正(N2)________(填“>”“<”“=”或“不能确定”)v逆(N2)。
③若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡________(填“向左”“向右”或“不”)移动;使用催化剂________(填“增大”“减小”或“不改变”)反应的ΔH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴是国民经济建设和国防建设不可缺少的重要原料之一,从锂离子二次电池正极![]() 废料--铝钴膜中回收钴的工艺如图所示:
废料--铝钴膜中回收钴的工艺如图所示:

回答下列问题:
(1)写出工业上用![]() 制取铝的化学方程式______
制取铝的化学方程式______
(2)工艺图中加入氢氧化钠净化的目的是______
(3)为使钴浸出。需将![]() 的结构破坏,选择在硫酸和双氧水体系中进行浸出,请写出浸出的化学方程式______
的结构破坏,选择在硫酸和双氧水体系中进行浸出,请写出浸出的化学方程式______
(4)锂可由电解制得,以石墨为阳极,低碳钢为阴极,电解液为熔融的LiCl和KCl的混合液,电解槽压为6.0-6.5V,这样可得到纯度为99%的锂。
①在电解液中加人KCl的原因______
②阴极产物与镁的性质相似,在常温下与氮气反应,请写出其与氮气反应的生成物与水的反应方程式______
③已知阴极产物在500℃与氢气能反应生成氢化物,请写出该氢化物的电子式______
(5)已知钴与铁的性质相似,请写出四氧化三钴与氢碘酸反应的离子方程式______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚甲基蓝(Methylnene Blue)在碱性条件下与葡萄糖作用生成亚甲基白(Methylene White),亚甲基蓝的结构简式:
著名的蓝瓶子实验操作步骤如下:
①如图示在250mL锥形瓶中,依次加入2g NaOH、100mL H2O和3g葡萄糖,搅拌溶解后,再加入3滴~5滴0.2%的亚甲基蓝溶液,振荡混合液呈现蓝色;
②塞紧橡皮塞(活塞a、b关闭),将溶液静置,溶液变为无色;
③再打开瓶塞,振荡,溶液又变为蓝色;
④再塞紧橡皮塞,将溶液静置,溶液又变为无色,以上③、④可重复多次。
试回答下列问题:

(1)某学生将起初配得的蓝色溶液分装在A,B两支试管中(如上图,A试管充满溶液,B中有少量溶液),塞上橡皮塞静置片刻,两溶液均显无色,若再同时振荡A,B试管,能显蓝色的是_________(填“A”或“B”);
(2)若塞紧锥形瓶塞并打开活塞a、b,通入足量氢气后,再关闭活塞a、b并振荡,溶液能否由无色变为蓝色_________(填“能”或“不能”);若塞紧锥形瓶塞并打开a、b通入足量氧气,溶液能否由无色变为蓝色_________(填“能”或“不能”);
(3)上述转化过程中,葡萄糖的作用是_________,亚甲基蓝的作用是_________;
(4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为维生素C具有_____;
(5)该实验中③、④操作能否无限次重复进行_________(填“能”或“不能”),理由是 _____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com