

| 实验方案 | 预测现象 | 预测依据 | 实际结果 |
| 实验1:向2mL Na2CO3溶液中滴加1mL 0.5mol•L-1CaCl2溶液 | 有白色 沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应. | 有白色沉淀 |
| 实验2:向2mL NaHCO3溶液中滴加1mL 0.5mol•L-1CaCl2溶液 | 无白色 沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应. | 既有白色沉淀出现,同时又有少量气泡冒出. |
分析 (1)无论碳酸钠还是碳酸氢钠都能和盐酸反应生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊,故Ⅰ无法鉴别;实验Ⅱ中,盐酸和碳酸氢钠反应立即产生气泡,盐酸和碳酸钠先反应生成碳酸氢钠,碳酸氢钠和盐酸反应生成二氧化碳气体,所以看到的现象不同,故能鉴别碳酸钠和碳酸氢钠,
(2)根据两个实验的区别分析;
(3)不直接加热碳酸氢钠就能分解更说明碳酸氢钠不稳定;
(4)碳酸钠能和氯化钙反应生成碳酸钙沉淀和氯化钠;CaCl2与NaHCO3溶液反应生成碳酸钙沉淀和二氧化碳气体.
解答 解:(1)无论碳酸钠还是碳酸氢钠都能和盐酸反应生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊,故Ⅰ无法鉴别;
实验Ⅱ中,盐酸和碳酸氢钠反应立即产生气泡,盐酸和碳酸钠先反应生成碳酸氢钠,碳酸氢钠和盐酸反应生成二氧化碳气体,所以看到的现象不同,故能鉴别碳酸钠和碳酸氢钠,
故答案为:Ⅱ;
(2)实验Ⅲ、Ⅳ相比,IV可以做到一套装置同时进行两个对比实验,而III不能,故选D,
故答案为:D;
(3)碳酸钠直接加热,碳酸氢钠不直接加热,不直接加热的碳酸氢钠能分解而直接加热的碳酸钠不分解更能说明碳酸氢钠不稳定,
故答案为:NaHCO3;
(4)实验1:碳酸钠能和氯化钙反应CaCl2+Na2CO3═CaCO3↓+2NaCl,离子反应为:Ca2++CO32-=CaCO3↓,
故答案为:Ca2++CO32-=CaCO3↓;
实验2:CaCl2与NaHCO3溶液可发生反应:CaCl2+2NaHCO3=CaCO3↓+2NaCl+CO2↑+H2O,离子反应为:Ca2++2HCO3-=CaCO3↓+CO2↑+H2O,
故答案为:Ca2++2HCO3-=CaCO3↓+CO2↑+H2O;
点评 本题考查Na2CO3和NaHCO3性质的异同,题目难度中等,注意把握Na2CO3和NaHCO3性质以及相关反应的方程式的书写,侧重于考查学生的分析能力和实验探究能力.


 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢气是一种环保、可再生的能源 | B. | 电解熔融AlCl3可制金属铝 | ||
| C. | 可溶性铁盐或铝盐常用于水的净化 | D. | 二氧化硅可用于制作光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | I1 | I2 | I3 | I4 |
| A | 2080 | 4000 | 6100 | 9400 |
| B | 500 | 4600 | 6900 | 9500 |
| C | 740 | 1500 | 7700 | 10500 |
| D | 580 | 1800 | 2700 | 11600 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 为了测量NaHCO3和Na2CO3混合物中Na2CO3的质量分数,有人设计了如下的装置.准确称取混合物样品m g盛于试管B中并连接装置,其中C、D为玻璃管,C带有刻度,回答下面有关小题.
为了测量NaHCO3和Na2CO3混合物中Na2CO3的质量分数,有人设计了如下的装置.准确称取混合物样品m g盛于试管B中并连接装置,其中C、D为玻璃管,C带有刻度,回答下面有关小题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
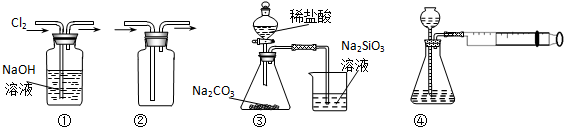
| A. | 装置①可用于除去Cl2中含有的少量HCl气体 | |
| B. | 装置④向左推动针筒活塞可检验该装置的气密性 | |
| C. | 装置③可证明非金属性Cl>C>Si | |
| D. | 按装置②所示的气流方向可用于收集H2、NH3等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤⑥ | B. | ②④⑤⑥ | C. | ⑤⑥ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1.0L1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 12g石墨烯(单层石墨)中含有C-12原子的个数为NA | |
| C. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1 NA | |
| D. | 1 mol的羟基与1 moL的甲基所含电子数均为9 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com