
【题目】下列物质中既能使溴水又能使酸性KMnO4溶液褪色的是( )
A. 甲苯 B. 乙烯 C. 苯 D. 己烷
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】用如图所示装置进行实验,将A逐滴加入B中:
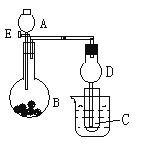
(1)若B为Na2CO3粉末,C为C6H5ONa溶液,实验中观察到小试管内溶液由澄清变浑浊,则试管C中化学反应的化学方程式: 。然后往烧杯中加入沸水,可观察到试管C中的现象: 。
(2)若B是生石灰,观察到C溶液中先形成沉淀,然后沉淀溶解。当沉淀完全溶解,恰好变澄清时,关闭E然后往小试管中加入少量乙醛溶液,再往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,则A是 (填名称),C是 (填化学式),与乙醛的混合后,该溶液中反应的化学方程式: 。实验结束时用 清洗银镜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液中粒子浓度的关系式中,正确的是

A.pH相同的①CH3COONa、②NaHCO3、③苯酚钠三份溶液中的c(Na+):③>②>①
B.0.lmol·L -1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+ c(HA-)+c(H2A)
C.上图中pH=7时:c(Na+)>c(CH3COO-)>c(OH-)=c(H+)
D.上图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+) +c(CH3COO-) +2c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁铝合金在碱性溶液中开始反应缓慢,后反应加快,经分析是氧化膜及微电池作用的结果。下列叙述正确的是( )
A. 微电池的负极是Mg B. 微电池的负极是Al
C. 铝的电极反应式为2H++2e-===H2↑ D. 镁的电极反应式为Mg-2e-===Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba3++4OH-=2BaSO4↓+A1O2-+2H2O
B. 向氧氧化亚铁中加人足量的稀硝酸:Fe(OH)2+2H+=Fe2++2H2O
C. 向磷酸二氢铵溶液中加入足量的氢氧化钠溶液:NH4++OH-=NH3H2O
D. 向CH2BrCOOH中加人足量的氧氧化钠溶液并加热:CH2BrCOOH+OH-→CH2BrCOO- +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对温室气体二氧化碳的研究一直是科技界关注的重点。
I.在催化剂存在下用H2还原CO2是解决温室效应的重要手段之一,相关反应如下:
主反应:CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H1①
副反应:CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41.2kJ/mol
已知H2和CH4的燃烧热分别为-285.5kJ·mol-1和-890.0kJ·mol-1
H2O(l)=H2O(g) △H=+44 kJ·mol-1
(1)△H1=______kJ·mo l-1。
(2)有利于提高CH4平衡产率的反应条件是(至少写两条)_________。工业上提高甲烷反应选择性的关键因素是_____________。
(3)T℃时,若在体积恒为2L的密闭容器中同时发生上述反应,将物质的量之和为5mol的H2和CO2以不同的投料比进行反应,结果如图所示。若a、b表示反应物的转化率,则表示H2转化率的是______,c、d分别表示CH4(g)和CO(g)的体积分数,由图可知![]() =______时,甲烷产率最高。若该条件下CO的产率趋于0,则T℃时①的平衡常数K=________。
=______时,甲烷产率最高。若该条件下CO的产率趋于0,则T℃时①的平衡常数K=________。

II.溶于海水的CO295%以HCO3-形式存在。在海洋中,通过如下左图钙化作用实现碳自净。

(4)写出写出钙化作用的离子方程式____________。
(5)电解完成后,a室的pH值______(“变大”、“变小”或“几乎不变”);其间b室发生反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们使用的塑料食品盒、水杯等通常由聚苯乙烯制成,下列说法正确的是
A.聚苯乙烯单体的分子式为C8H8
B.聚苯乙烯属于纯净物
C.聚苯乙烯能与溴水发生加成反应
D.聚苯乙烯是可降解塑料,不会造成白色污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(1)B、C中第一电离能较大的是___________(用元素符号填空),基态D原子价电子的轨道表达式为______。
(2)DA2分子的VSEPR模型是___________。
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
①C2Cl6属于______晶体(填晶体类型),其中C原子的杂化轨道类型为____杂化。

②[C(OH)4]-中存在的化学键有________。
⑷B、C的氟化物晶格能分别是2957 kJ·mol-1 、5492 kJ·mol-1 ,二者相差很大的原因是____________。
(5)D与E形成化合物晶体的晶胞如下图所示:

①在该晶胞中,E的配位数为__________。
②原子坐标参数可表示晶胞内部各原子的相对位置。上图晶胞中,原子的坐标参数为a为(0,0,0);b(1/2,0,1/2);c为(1/2,1/2,0)。则d原子的坐标参数为_______。
③已知该晶胞的密度为ρg/cm3,则其中两个D原子之间的距离为____pm(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com