
 a.操作①中为加热焙烧速率和提高原料的利用率,可采取的措施是将铬铁矿粉碎(答一条即可).
a.操作①中为加热焙烧速率和提高原料的利用率,可采取的措施是将铬铁矿粉碎(答一条即可).| 温度/K | 480 | 505 | 615 | 730 |
| 质量/g | 94.67 | 92.00 | x | 76.00 |
| 化学式 | Cr3O8 | y | CrO2 | Cr2O3 |
分析 (1)a、根据影响化学反应速率的因素:物质的表面积大小来回答;
b、Na2CrO4中加酸化的氯化钡溶液有白色沉淀铬酸钡生成;
(2)用铁作电极提供Fe2+,此时金属铁在阳极上作为活泼金属电极,Cr2O72-将Fe2+氧化生成Fe3+,本身被还原生成Cr3+,据此回答;
(3)根据质量守恒定律,在变化过程中,Co的质量没有变,求出氧原子和铬原子的个数比即可.
解答 解:(1)a、影响化学反应速率的因素:物质的表面积大小,表面积越大,反应速率越快,加热焙烧速率和提高原料的利用率,可采取的措施是:将铬铁矿粉碎,故答案为:将铬铁矿粉碎;
b、浸出液中含有的主要成分为Na2CrO4,向滤液中加酸化的氯化钡溶液,会发生复分解反应产生白色沉淀铬酸钡,反应为:CrO42-+Ba2+=BaCrO4↓,故答案为:CrO42-+Ba2+=BaCrO4↓;
(2)用铁作电极提供Fe2+,此时金属铁在阳极上作为活泼金属电极,级铁作电解槽的阳极,阴极上氢离子放电生成氢气,2H++2e-=H2↑,FeSO4具有还原性,可与Cr2O72-+发生氧化还原反应生成Fe3+和Cr3+,反应的离子方程式为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,
故答案为:阳;2H++2e-=H2↑;6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
(3)CrO3的质量为100g,则CrO3中铬元素的质量为:100g×$\frac{52}{52+16×3}$=52g,Cr的质量没有变,Cr和O两者的个数比为2:1,此时剩余固体的质量x比原来的质量减少了1个氧原子,质量是100g-16g=84g,原来固体质量为100g,B点质量=92g,Cr的质量不变,为52g,则此时氧元素质量=92g-52g=40g,此时成分中Cr和O元素原子个数之比=$\frac{52}{52}:\frac{40}{16}$=2:5,所以B点成分化学式为Cr2O5,故答案为:Cr2O5.
点评 本题考查较综合,涉及反应速率的影响因素、电解池原理、氧化还原反应等知识点,同时考查学生获取信息、加工信息能力及图象分析能力,题目难度中等.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:解答题
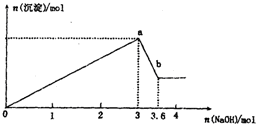 现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图.
现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸除去水垢中:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 铜和浓硝酸反应:Cu+4H++2NO${\;}_{3}^{-}$═Cu2++2NO2↑+2H2O | |
| C. | 向氨水中通入过量SO2:2NH3•H2O+SO2═2NH${\;}_{4}^{+}$+SO${\;}_{3}^{2-}$+H2O | |
| D. | H2SO4溶液和Ba(OH)2溶液:H++SO${\;}_{4}^{2-}$+Ba2+═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验装置图 |  |  |  |  |
| 实验现象 | 乙装置中有亮光通路,甲装置无明显现象 | 关闭止水夹,捂住圆底烧瓶,导管中水柱上升后静止不动 | 打开止水夹,挤压胶头滴管中的水,有喷泉产生 | 电流表指针发生偏转 |
| 实验结论 | 甲装置中分散系不是胶体,乙装置中分散系为胶体 | 该装置气密性良好 | HCl易溶于水 | 电子从铝箔流出,经电流表、活性炭、滤纸回到铝箔 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与稀盐酸反应CO32-+2H+═CO2↑+H2O | |
| B. | 稀硫酸与氯化钡溶液反应Ba2++SO42-═BaSO4 | |
| C. | 氢氧化镁与稀硫酸反应OH--+H+═H2O | |
| D. | 铁钉放入硫酸铜溶液中2Fe+3Cu2+═2Fe3++3Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非自发反应在任何条件下都不能实现 | |
| B. | 自发反应都是熵增大的反应 | |
| C. | 能自发进行的吸热反应一定是熵增大的反应 | |
| D. | 自发反应都是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com