
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 一定条件下,将0.5 mol N2和1.5 molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
分析 A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量分析;
B、0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol;
C、依据热化学方程式的书写方法写出,注意物质聚集状态和反应的焓变;
D、H2SO4和Ba(OH)2反应生成硫酸钡沉淀,不仅仅生成水.
解答 解:A、根据燃烧热的概念:1mol可燃物完全燃烧生成稳定的氧化物,所放出的热量为燃烧热,水的状态应该为液态,故A错误;
B、0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol,所以其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H<-38.6 kJ/mol,故B错误;
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ/mol,故C正确;
D.H2SO4和Ba(OH)2反应生成硫酸钡沉淀,不仅仅生成水,放出更多的热量,则H2SO4和Ba(OH)2反应的中和热△H<-57.3kJ/mol,故D错误;
故选:C.
点评 本题考查了燃烧热、中和热概念以及热化学方程式书写,明确概念的内涵是解题关键,题目难度不大.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4溶液 | B. | 盐酸 | C. | NaOH溶液 | D. | Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图装置可用于制取、提纯并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
如图装置可用于制取、提纯并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( ) | 选项 | 气体 | a | b | c |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | SO2 | 浓硫酸 | Cu | 酸性KMnO4溶液 |
| C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| D | CO2 | 稀硝酸 | CaCO3 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH中H的化合价为-1价 | B. | H2O既不是氧化剂也不是还原剂 | ||
| C. | 该反应的离子方程式为:H-+H+═H2↑ | D. | NaOH是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
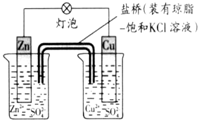
| A. | 正极反应为:Zn-2e-=Zn2+ | B. | Cu为负极,发生还原反应 | ||
| C. | 盐桥中的K+移向ZnSO4溶液 | D. | 在外电路中,电子从负极流向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg?L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com