
某溶液可能含有Clˉ、SO42ˉ、CO32ˉ、NH4+、Fe3+、Fe2+、Al3+和Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验: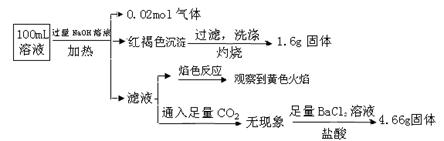
由此可知原溶液中
| A.原溶液中c(Fe3+)="0.2" mol·L-1 |
| B.溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol·L-1 |
| C.SO42ˉ、NH4+、Na+一定存在,CO32ˉ、Al3+一定不存在 |
| D.要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入适量氯水,无现象,再加KSCN溶液,溶液成血红色,则含有Fe2+ |
B
解析试题分析:根据设计并完成的实验:①加入过量NaOH溶液,加热,得到0.02mol气体,说明有NH4+,而且为0.02mol。同时产生红褐色沉淀,说明有Fe3+,但由于Fe2+极易被氧化为Fe3+,所以这里不能排除原溶液中没有Fe2+存在,又由于Fe3+(或Fe2+)不能与CO32ˉ共存,所以原溶液中就没有CO32ˉ,且根据过滤、洗涤、灼烧后得1.6g固体(Fe2O3)可知Fe离子为0.02mol。②滤液焰色反应呈黄色,说明有Na+,但不能说明有原溶液中一定Na+,因为在加入过量NaOH溶液时,引入了Na+。③根据不溶于盐酸的4.66g沉淀,说明有SO42-,且为0.02mol。④根据电荷守恒可知一定有Cl-,且至少有0.02mol,因为如果原溶液中有Na+,则Cl-大于0.02mol,即c(Clˉ)≥0.2 mol·L-1。由此可知,原溶液中NH4+、 SO42ˉ、Clˉ一定存在,Fe3+或Fe2+至少有一种存在;Na+可能存在也可能不存在;CO32ˉ、Al3+一定不存在。所以,选项B正确,选项A、C、D错误。
考点:离子的鉴别、检验


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
某无色溶液X,由K+、NH4+、Ba2+、Al3+、Fe3+、CO32—、SO42—
中的若干种离子组成,取该溶液进行如下实验: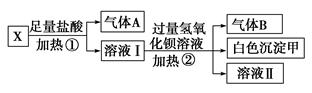
(1)白色沉淀甲是________。
(2)试写出实验过程中生成气体A、B的离子方程式
__________________________、_______________________________
(3)通过上述实验,可确定X溶液中一定存在的离子是
________,尚未确定是否存在的离子是________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下面是同学们熟悉的物质:
①O2 ②金刚石 ③NaBr ④H2SO4 ⑤Na2CO3
⑥NH4Cl ⑦NaHSO4 ⑧Ne ⑨Na2O2 ⑩NaOH
(1)这些物质中,只含有共价键的是________;只含有离子键的是________;既含有共价键又含有离子键的是________;不存在化学键的是________。
(2)属于共价化合物的是________;属于离子化合物的是________。
(3)将NaHSO4溶于水,破坏了NaHSO4中的________,写出其电离方程式_________________________;
NaHSO4在熔融状态下电离,破坏了________,写出其电离方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
大气中硫、氮的氧化物是形成酸雨的主要物质。某地酸雨中可能含有下列离子:Na+、Ba2+、NH4+、Al3+、Cl-、SO32-、SO42-、NO3-等。某研究小组取该地一定量的酸雨,浓缩后将所得澄清试液分成三份,进行如下实验:
| 试样 | 所加试剂 | 实验现象 |
| 第一份试液 | 滴加适量的淀粉KI溶液 | 溶液呈蓝色 |
| 第二份试液 | 滴加用盐酸酸化的BaCl2溶液 | 有白色沉淀产生 |
| 第三份试液 | 滴加NaOH溶液,加热,加入的NaOH溶液体积(V)与生成的沉淀、产生的气体的物质的量(n)的关系如右图 | 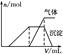 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.铁盐、亚铁盐是实验室常用的药品。
请根据题意,完成下列填空:
(1)向酸化的FeCl3溶液中逐滴加入KI溶液,溶液变成棕褐色。该反应的离子方程式为________________。
(2)向酸化的FeSO4溶液中加几滴硫氰化钾溶液,没有什么明显变化,再滴加双氧水,溶液变血红色。继续滴加双氧水,血红色逐渐褪去,且有气泡产生。
写出上述变化中,有关反应的离子方程式:
①____________________________________;
②Fe3++3SCN-=Fe(SCN)3;
③11H2O2+2SCN-=2SO42—+2CO2↑+N2↑+10H2O+2H+
若生成1 mol N2,H2O2和SCN-的反应中转移电子的物质的量是________ mol。
(3)根据以上实验,推断Fe2+、I-和SCN-的还原性由强到弱的顺序为________。
Ⅱ.某课题组利用Fe粉和KNO3溶液反应,模拟地下水脱氮过程,探究脱氮原理。
(4)实验前:①先用0.1 mol·L-1 H2SO4洗涤Fe粉,其目的是__________,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液通入________(写化学式)。
(5)如图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应生成的阳离子分别是________、________。t1时刻后,该反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是__________________。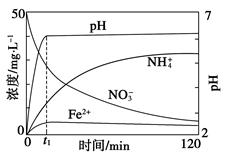
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在灾后重建中,饮用水安全占有极为重要的地位,某研究小组提取三处被污染的水源进行分析,并给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E五种常见化合物都是由下表中的离子形成的:
| 阳离子 | K+、Na+、Cu2+、Al3+ |
| 阴离子 | SO42—、HCO3—、NO3—、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下: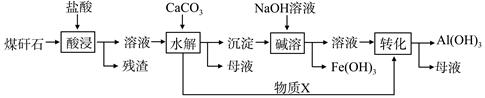
(1)“酸浸”过程中主要反应的离子方程式为_____________、_________________。
(2)“酸浸”时铝浸出率的影响因素可能有_____________、___________。(写出两个)
(3)物质X的化学式为___________。“碱溶”时反应的离子方程式为____________。
(4)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4。为了获得产品Al(OH) 3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是____________________。
(5)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向AlCl3溶液中不断通入HCl气体,可析出大量AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
离子反应是中学化学中重要的反应类型,回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在________(填编号)。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)一种无色透明溶液中,可能含有下列离子: 、
、 、I-和Cl-,取该溶液进行如下实验:
、I-和Cl-,取该溶液进行如下实验:
①将溶液滴在蓝色石蕊试纸上,呈红色。
②将少许溶液浓缩后加入铜片和硫酸,有无色气体析出,此气体通空气则立即变成红棕色。
③取少许溶液滴入BaCl2溶液,则产生白色沉淀。
④取实验③中的澄清溶液,滴入AgNO3试液,产生不溶于稀硝酸的白色沉淀。
⑤另取少许溶液,滴入NaOH溶液,有白色沉淀生成,当NaOH过量时,又有部分白色沉淀溶解。
根据以上现象判断,原溶液中肯定不存在的离子是_______;肯定存在的离子是_______;不能作出判断的离子是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.(4分)实验室有一瓶澄清的溶液,实验人员确定其中可能含有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、Cl-、I-、NO3-、CO32-、SO42-,取该溶液进行下列实验:
①取pH试纸检验,表明溶液呈强酸性。
②取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4层呈紫红色。
③另取部分溶液逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生。
④取部分上述碱性溶液加Na2CO3溶液,有白色沉淀生成。
⑤将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
⑥向②的水层中加入HNO3酸化的AgNO3溶液有白色沉淀。
根据上述实验事实确定,请你判断该溶液中
(1)肯定存在的离子是 ;
(2)不能确定是否存在的离子是 。
Ⅱ. (6分)二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式 。
(2)已知:Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O→Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是 。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+ 4KI+ 4HNO3→Se+2I2+ 4KNO3+2H2O ②I2+2Na2S2O3→Na2S4O6+2NaI
实验中,准确称量SeO2样品0.1500g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com