
| A. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓ | |
| B. | 用醋酸除水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 利用腐蚀法制作印刷线路板:Fe3++Cu=Fe2++Cu2+ | |
| D. | 实验室用溴和苯在催化剂作用下制溴苯: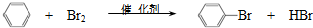 |
分析 A.溴乙烷为非电解质,不能电离;
B.醋酸为弱电解质,应保留化学式;
C.电荷不守恒;
D.溴和苯在催化剂作用发生取代反应生成溴苯.
解答 解:A.溴乙烷为非电解质,不能电离,加入硝酸银溶液,不会发生反应,故A错误;
B.用醋酸除水垢,离子方程式:CaCO3+2CH3COOH=Ca2++H2O+CO2↑2CH3COO-,故B错误;
C.利用腐蚀法制作印刷线路板:2Fe3++Cu=2Fe2++Cu2+,故C错误;
D.溴和苯在催化剂作用下制溴苯,化学方程式: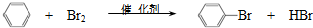 ,故D正确;
,故D正确;
故选:D.
点评 本题考查了化学方程式、离子方程式书写,明确溴乙烷、苯的结构是解题关键,注意离子方程式、化学方程式应遵循原子守恒规律,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | (3)(5)(8) | B. | (5)(7)(8) | C. | (5)(8) | D. | (3)(5)(7)(8) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
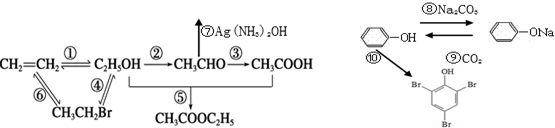
 ,取代反应.
,取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2分子的结构式:O=C=O | B. | 氮气的电子式: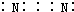 | ||
| C. | 钙离子的电子式:Ca2+ | D. | Na的原子结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | T/℃ | 大理石 规格 | HNO3浓度 (mol?L-1) | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究大理石规格(粗、细)对该反应速率的影响; |
| ② | ||||
| ③ | 粗颗粒 | 2.00 | ||
| ④ | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将0.40mol N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H.在Tl℃和T2℃时,测得NO2的物质的量随时间变化如图所示:
将0.40mol N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H.在Tl℃和T2℃时,测得NO2的物质的量随时间变化如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com