
| a/g | 起始读数/mL | b/mL | c/mL |
| 0.1970 | 0.00 | 31.30 | 42.40 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:实验题
 Fe2O3 + SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是( )
Fe2O3 + SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是( )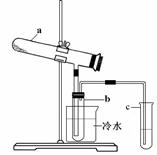
| A.若将反应后的三种气体通入BaCl2溶液中,产生的沉淀为BaSO3、BaSO4 |
| B.b中产物用紫色石蕊试液即可检验出其中H+和SO42— |
| C.为检验反应的另一种生成物,试管c中应加入的试剂为NaOH溶液 |
| D.b中所得到的硫酸的质量分数为29.5% |
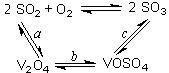
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
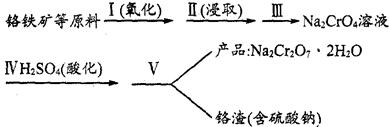
 8Na2CrO4(s)+2Fe2O3(s)+8CO2,该反应的化学平衡常数的表达式为)_____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________ 。
8Na2CrO4(s)+2Fe2O3(s)+8CO2,该反应的化学平衡常数的表达式为)_____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________ 。| A.升高温度 | B.将原料粉碎 | C.增加纯碱的用量 | D.通入过量的空气 |
| 序号 | 实验步骤 | 简述实验操作(不必叙述如何组装实验装置) |
| ① | 溶解 | 将混合物放入烧杯中、加水、充分搅拌直到固体不能溶解 |
| ② | | |
| ③ | | |
| ④ | | |
| ⑤ | 过滤、干燥 | 得到K2Cr2O7晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
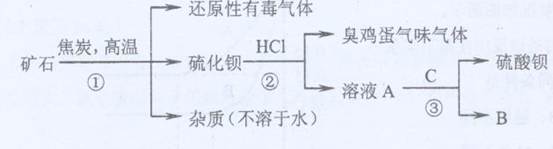 (1)写出步骤①的化学反应方程式 ,该反应产生的气体具有 、 等用途。
(1)写出步骤①的化学反应方程式 ,该反应产生的气体具有 、 等用途。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
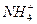 、
、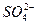 、Fe2+和结晶水,设计了下列操作步骤:①取少量该化合物加热,发现试管口处有液体,该液体能使无水硫酸铜变蓝;②另取少量该化合物溶于水中,滴加少量的氯水,再加入KSCN溶液,有血红色出现;③取少量溶液于试管中,加入盐酸,没有现象,再加入BaCl2溶液,有白色沉淀生成;④取少量溶液于试管中,加入浓的NaOH溶液,微热有使湿润的红色石蕊试纸变蓝的气体产生,同时也有白色沉淀产生,该沉淀很快变成灰绿色沉淀。
、Fe2+和结晶水,设计了下列操作步骤:①取少量该化合物加热,发现试管口处有液体,该液体能使无水硫酸铜变蓝;②另取少量该化合物溶于水中,滴加少量的氯水,再加入KSCN溶液,有血红色出现;③取少量溶液于试管中,加入盐酸,没有现象,再加入BaCl2溶液,有白色沉淀生成;④取少量溶液于试管中,加入浓的NaOH溶液,微热有使湿润的红色石蕊试纸变蓝的气体产生,同时也有白色沉淀产生,该沉淀很快变成灰绿色沉淀。| A.②中的现象说明一定有Fe2+ |
B.为了检验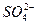 ,可以将③中的试剂换为HNO3酸化的Ba(NO3)2 ,可以将③中的试剂换为HNO3酸化的Ba(NO3)2 |
| C.通过上述实验可确定该化合物的化学式为(NH4)2Fe(SO4)2·6H2O |
| D.④中的沉淀长时间放置会变成红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
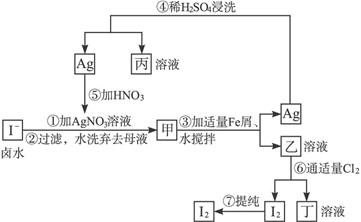
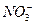 b.除去未反应的I-
b.除去未反应的I-查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com