
| m |
| M |
| V |
| Vm |
| V |
| Vm |
| n |
| V |
| 16g |
| 32g/mol |
| 11.2L |
| 22.4L/mol |
| 3.36L |
| 22.4L/mol |
| 0.15mol |
| 0.5L |


科目:高中化学 来源: 题型:
| A、实验室的氯水需要保存在棕色试剂瓶中 |
| B、漂白粉比氯水稳定,可露置在空气中 |
| C、称量氢氧化钠固体时,可在天平两个托盘上各放一张等质量的纸,左边纸上放NaOH,右边纸上放砝码 |
| D、金属钠可保存在煤油、四氯化碳等有机溶剂中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
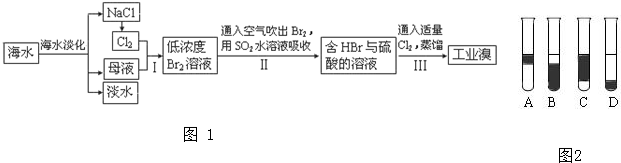
查看答案和解析>>
科目:高中化学 来源: 题型:
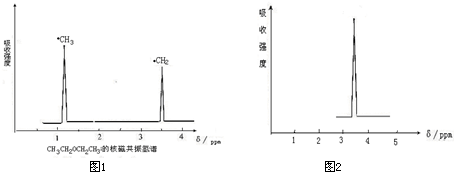
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)铁、铝、铜是人类使用广泛的三种金属.
(1)铁、铝、铜是人类使用广泛的三种金属.| 原料 | 杂木屑 | 麦麸 | 生石灰(粉) | 过磷酸钙 |
| 质量(kg) | 200 | 50 | 2.5 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元 素 | Mn | Fe | |
| 电离能 /kJ?mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
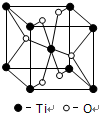
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com