
| A. | ①② | B. | ①④ | C. | ③④⑥ | D. | ②③⑤ |
分析 强弱电解质的根本是电离程度,部分电离的电解质是弱电解质,要说明HF是弱电解质,只要能证明HF部分电离即可,据此分析解答.
解答 解:①常温下NaF溶液的pH大于7,说明NaF是强碱弱酸盐,则HF是弱酸,为弱电解质,故正确;
②1mol/L HF溶液能使紫色石蕊试液变红,说明HF溶液呈酸性,但不能说明HF部分电离,所以不能证明HF是弱电解质,故错误;
③HF与NaCl不能发生反应,说明不符合复分解反应条件,但不能说明HF部分电离,所以不能证明HF是弱电解质,故错误;
④常温下0.1mol/LHF溶液的pH为2.3,说明氢离子浓度小于HF浓度,则HF部分电离,为弱电解质,故正确;
⑤HF能与Na2CO3溶液反应产生CO2,说明HF酸性大于碳酸,但不能说明HF部分电离,所以不能证明HF是弱电解质,故错误;
⑥HF与水能以任意比混溶,说明HF的溶解性强,但不能说明HF部分电离,所以不能证明HF是弱电解质,故错误;
故选B.
点评 本题考查弱电解质强弱判断,为高频考点,明确强弱电解质的根本区别是解本题关键,可以根据其电离程度判断,但不能根据物质的溶解性强弱、电解质溶液导电性强弱判断,易错选项是③⑤.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 盐酸 | 冰水混合物 | 小苏打 | 干冰 |
| B | 蒸馏水 | 氨水 | 火碱 | 二氧化硫 |
| C | 硫酸 | 胆矾 | 纯碱 | 氨气 |
| D | 硝酸 | 食盐 | 氢氧化钠溶液 | 生石灰 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
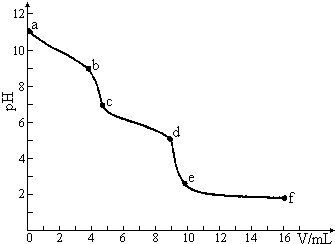 常温下,用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如下图(已知:饱和CO2溶液的pH为5.6),下列说法正确的是 ( )
常温下,用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如下图(已知:饱和CO2溶液的pH为5.6),下列说法正确的是 ( )| A. | 该Na2CO3溶液的浓度为0.001mol/L | |
| B. | 在pH=7时,c(Na+)=c(Cl-) | |
| C. | 在pH=6时,c(Na+)>c(HCO3-)>c(CO32-) | |
| D. | c→d发生的主要离子反应为:CO32-+H+=HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 1mol/L醋酸溶液加水稀释后,所有离子浓度均减小 | |
| B. | Na2CO3溶液中,一定有2c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-) | |
| C. | 等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa) | |
| D. | 1 mol•L-1HCN溶液与1mol•L-1NaOH溶液等体积混合后,测得所得溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉溶液通入SO2:Ca2++2ClO-+SO2+H2O═2HClO+CaSO3↓ | |
| B. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 少量的Na2SO3溶液滴加到足量稀盐酸中:SO32-+2H+═H2O+SO2↑ | |
| D. | 硅酸钠溶液中通入过量二氧化碳:SiO32-+CO2+H20═H2SiO3(胶体)+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
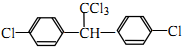 .下列有关DDT的说法正确的是( )
.下列有关DDT的说法正确的是( )| A. | 它属于芳香烃 | B. | 分子中最多有23个原子共平面 | ||
| C. | 分子式为C14H9Cl5 | D. | 能发生水解反应和消去反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com