
【题目】下列说法可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
①一个N≡N键断裂的同时,有6个N-H键断裂
②v(H2)=0.6 mol·L-1·min-1,v(NH3)=0.4 mol·L-1·min-1
③保持其他条件不变时,体系压强不再改变
④NH3、N2、H2的体积分数都不再改变
⑤恒温恒容时,混合气体质量保持不变
A. ②③④ B. ①③④ C. ①②④ D. ③④⑤
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】氨是重要的化工产品之一,有着广泛的用途,运用化学反应原理的相关知识研究氨的合成及性质对工业生产有着十分重要意义。
I.合成氨用的氢气可以甲烷为原料制得:CH4(g)+H2O(g) ![]() CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O (g)反应生成CO (g)和H2 (g)的热化学方程式为______________。
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O (g)反应生成CO (g)和H2 (g)的热化学方程式为______________。
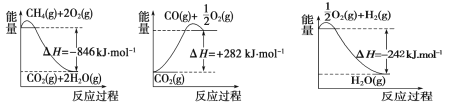
II.恒温下,将一定量N2、H2置于10L的容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.0kJ/mol,反应过程中各物质的物质的量随时间变化如下图。
2NH3(g) △H=-92.0kJ/mol,反应过程中各物质的物质的量随时间变化如下图。
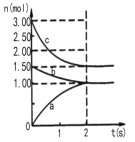
(1)图中0~2s内的反应速率v(NH3)=______;该温度下达平衡时N2的转化率为_____。
(2)若其它条件不变,将恒容条件变为恒压,则平衡时c(N2)__,平衡常数___。(填编号)
A.增大 B.减小 C.不变 D.不能确定
(3)在不同温度下达到平衡时测得NH3的体积分数如下表所示:
T/℃ | 200 | 300 | 400 |
NH3的体积分数 | a1 | a2 | 38% |
①试比较a1、a2的大小:a1_____a2(填“>”、“<”或“=”)。
②若反应在恒容400℃条件下进行,下列能判断反应达到平衡状态的依据有____ (填编号)。
A.断裂1molH-H键同时断裂2molN-H键 B.v正(N2)=3V逆(H2)
C.容器内N2、H2、NH3;的物质的量之比为1:3:2 D.平衡常数保持不变
E.混合气体的平均相对分子质量保持不变 F.混合气体的密度保持不变
(4)工业上合成氨采用了高温高压、催化剂的条件,根据反应判断下列哪些条件有利于提高氨的产率____。
A.采用400℃~500℃高温 B.采用合适的高压
C.使用铁触媒做催化剂 D.将氨液化从体系中分离出来
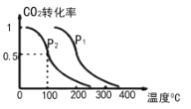
(5)氨气制取尿素[CO (NH2)2]的反应:2NH3 (g) +CO2(g) ![]() CO (NH2)2 (1)+H2O (g)。
CO (NH2)2 (1)+H2O (g)。
①该反应温度升高,氨气的百分含量增大,则△H______0(填“>”、“<”或“=”)。
②CO的平衡转化率与温度、压强的关系如图所示, 若充入2mol NH3与1mol CO2在2L密闭容器中进行反应,则100℃时反应的平衡常数K=________;压强的大小关系:P1______P2(填“>”、“<”、“=”或“不确定”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别向2L 0.5mol·L-1的KOH的溶液中加入适量的①浓硫酸、②稀醋酸、③稀盐酸,恰好完全反应的热效应分别为△H1、△H2、△H3 , 下列关系正确的是 ( )
A.ΔH1<ΔH3<ΔH2
B.ΔH1>ΔH2>ΔH3
C.ΔH1>ΔH2=ΔH3
D.ΔH1<ΔH2<ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】玻尔认为原子核外电子离核越近能量越低。那么,电子从离核无穷远处跃迁到氢离子(H+)的K层所释放的光子在氢原子的发射光谱中对应( )的光子
A. 波长最长 B. 波长最短 C. 平均波长 D. 中间波长
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于能量转换的认识中不正确的是
A. 煤燃烧时化学能主要转变成热能
B. 电解水生成氢气和氧气时,电能转化成化学能
C. 白炽灯工作时电能全部转变成光能
D. 绿色植物光合作用过程中太阳能转变成化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2做原料的燃料电池,负极材料采用Pt/C.正极材料采用MnO2,可用做空军通信卫星电源,其工作原理如图所示。下列说法中不正确的是

A. 电池放电时Na+从a极区移向b极区
B. 燃料电池是一类能量转化效率高、环境友好的发电装置
C. 该电池的负极反应为BH4-+ 8OH-一8e-═BO2-+ 6H2O
D. 在电池反应中,每消耗3molH2O2,转移电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。下表是4种常见指示剂的变色范围:
指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
(1)反应生成的CH3COONa显_________f性,用离子方程式解释原因:____________,则实验中应选用上表中的__________作指示剂。
(2)用标准的NaOH溶液滴定待测的白醋时,如何判断滴定终点:_________________。
(3)第一次滴定前后,碱式滴定管中的液面位置如右图所示,请将有关数据填入下面表格的空白处。
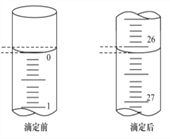
滴定次数 | 待食用白醋的体积/mL | 0.1000 mol/L NaOH溶液的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | ______ | _______ | ________ |
第二次 | 25.00 | 1.56 | 28.08 | 26.52 |
第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(4)从上表可以看出,第二次实验中记录消耗NaOH溶液的体积明显多于其余两次,其原因可能是________。
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
C.第二次滴定用的锥形瓶用待装液润洗过
D.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(5)根据所给数据,计算该白醋中醋酸的物质的量浓度:c=______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com