
【题目】在25℃时,pH=12的NaOH溶液100mL,欲使它的pH降为11,需加入pH=10的NaOH溶液mL; 在25℃时,有pH为a的盐酸和pH为b的NaOH溶液等体积混合:若a+b=13,则溶液呈性;pH为2的盐酸和pH为12的NaOH溶液,由水电离的氢离子浓度之比为 .
【答案】1000;酸;1:1
【解析】解:在25℃时,pH=12的NaOH溶液中c(OH﹣)= ![]() mol/L=0.01mol/L,欲使它的pH降为11,pH=11的NaOH溶液中c(OH﹣)=
mol/L=0.01mol/L,欲使它的pH降为11,pH=11的NaOH溶液中c(OH﹣)= ![]() mol/L=0.001mol/L,pH=10的溶液中c(OH﹣)=
mol/L=0.001mol/L,pH=10的溶液中c(OH﹣)= ![]() mol/L=0.0001mol/L, 设加入pH=10的NaOH溶液体积为VL,
mol/L=0.0001mol/L, 设加入pH=10的NaOH溶液体积为VL,
c(OH﹣)= ![]() mol/L=0.001mol/L=
mol/L=0.001mol/L= ![]() ,
,
V=1,即1000mL;
在25℃时,有pH为a的盐酸溶液中c(H+)=10﹣a mol/L,pH为b的NaOH溶液中c(OH﹣)=10 b﹣14 mol/L,二者等体积混合,若a+b=13,c(OH﹣)=10 b﹣14 mol/L=10 b﹣(a+b+1) mol/L=10 ﹣(a+1) mol/L<10﹣a mol/L,二者等体积混合酸有剩余,溶液呈酸性;
酸或碱抑制水电离,pH为2的盐酸和pH为12的NaOH溶液中水电离出的c(H+)都为 ![]() mol/L=10﹣10 mol/L,所以二者电离出的氢离子浓度之比为1:1,
mol/L=10﹣10 mol/L,所以二者电离出的氢离子浓度之比为1:1,
所以答案是:1000;酸;1:1.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是( )
A.2mol/L Ba(OH)2溶液中Ba2+的物质的量和OH﹣的物质的量
B.200mL 1mol/L氯化钙溶液中c(Cl﹣)和100 mL 2mol/L氯化钾溶液中c(Cl﹣)
C.20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度
D.64g二氧化硫中氧原子数和标准状况下22.4L一氧化碳中氧原子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定碱式碳酸钴[COx(OH)y(CO3)z]的化学组成,研究性学习小组的同学设计了如图所示的装置进行实验探究.已知:碱式碳酸钴受热时可分解生成三种氧化物. 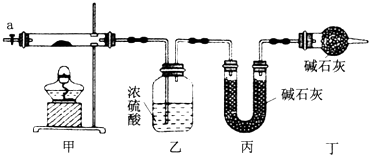
(1)按如图所示装置组装好仪器,并;称取3.65g样品置于硬质玻璃管内,加热,当乙装置中(填实验现象),停止加热;打开活塞a,缓缓通入空气数分钟,通入空气的目的是 .
(2)某同学认为上述实验中存在一个缺陷,该缺陷是 .
(3)通过正确实验测得乙、丙装置增重分别为0.36g、0.88g,则该碱式碳酸钴的化学式为 .
(4)CoCl26H2O常用作多彩水泥的添加剂.以含钴废料(含少量Fe、Al等杂质)制取COCl26H2O的一种工艺如下: 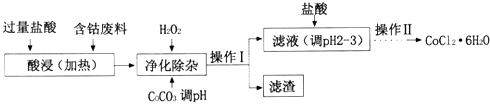
已知;25℃时
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
①净化除杂时,加入H2O2发生反应的离子方程式为;
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为;
③加盐酸调整pH为2~3的目的为;
④操作Ⅱ过程为蒸发浓缩、冷却结晶、过滤.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于反应:mA(g)+nB(g)cC(g)+dD(g),C物质的质量分数(C%)与温度、压强的关系如图所示,下列判断正确的是( ) 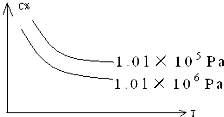
A.△H<0△S>0
B.△H>0△S<0
C.△H>0△S>0
D.△H<0△S<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时某些弱酸的电离平衡常数如下表所示:
CH3COOH | HClO | H2CO3 |
K(CH3COOH) | K(HClO) | K(H2CO3)a1=4.4×10﹣7 |
常温下,稀释CH3COOH、HClO两种酸时,溶液的pH随加水量变化的曲线如图所示,下列说法正确的是( )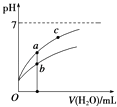
A.相同浓度的CH3COOH和HClO的混合溶液中,各离子浓度的大小关系是:c(H+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)
B.图象中a、c两点所处的溶液中 ![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
C.图象中a点酸的浓度大于b点酸的浓度
D.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO﹣+CO2+H2O=2HClO+CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中加入4molA、1.2molC和一定量的B三种气体,一定条件下发生反应,各物质的浓度随时间变化如甲图所示[已知t0~t1阶段保持恒温、恒容,且c(B)未画出].乙图为t2时刻后改变反应条件,反应速率随时间的变化情况,已知在t2、t3、t4、t5时刻各改变一种不同的条件,其中t3时刻为使用催化剂. 
(1)若t1=15s,则t0~t1阶段的反应速率为v(C)= .
(2)t4时刻改变的条件为 , .
(3)已知t0~t1阶段该反应放出或吸收的热量为Q kJ(Q 为正值),试写出该反应的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHCO3和 KHCO3的混合物6.2g与100mL 盐酸恰好完全反应,得到标准状况下CO2的体积为1.568L.求:
(1)混合物中NaHCO3的质量是多少?
(2)盐酸的物质的量的浓度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下.甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O.下列说法不正确的是( ) 
A.右电极为电池正极,b处通入的物质是空气
B.左电极为电池负极,a处通入的物质是空气
C.负极反应式为:CH3OH+H2O﹣6e﹣=CO2+6H+
D.正极反应式为:O2+4H++4e﹣=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂生产的某产品只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等). 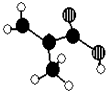
(1)该产品的结构简式为;
(2)下列物质中,与该产品互为同分异构体的是(填序号),与该产品互为同系物的是(填序号).
①CH3CH=CHCOOH ②CH2=CHCOOCH3 ③CH3CH2CH=CHCOOH ④CH3CH(CH3)COOH
(3)在一定条件下,该产品跟乙二醇反应可得到分子式为C6H10O3的物质,该物质发生加聚反应可得到用来制作隐形眼镜的高分子材料,这种高聚物的结构简式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com