
| A.由水电离出的c(H+)=10-9 mol/L的HF溶液 |
| B.pH=10的氨水 |
| C.1 mol/L的NaHCO3溶液 |
| D.10-9 mol/L的AgNO3溶液 |


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源:不详 题型:单选题
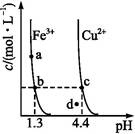
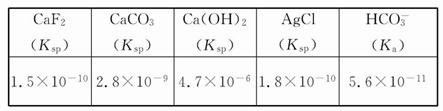
| A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2] |
| B.加适量NH4Cl固体可使溶液由a点变到b点 |
| C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等 |
| D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.MgCO3、CaCO3、MnCO3的KSP依次增大 |
| B.a点可表示 MnCO3的饱和溶液,且c(Mn2+)=c(CO32-) |
| C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) |
| D.c点可表示MgCO3的不饱和溶液,且c(Mg2+)>c(CO32-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
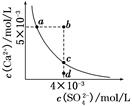
| A.在任何溶液中,c(Ca2+)、c(SO42-)均相等 |
| B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L |
| C.a点对应的Ksp等于c点对应的Ksp |
| D.d点溶液通过蒸发可以变到c点 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.AgCl不溶于水,不能转化为AgI |
| B.两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的物质 |
| C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于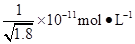 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 物质 | AgCl | AgI | Ag2S |
| 颜色 | 白 | 黄 | 黑 |
| Ksp(25 ℃) | 1.8×10-10 | 1.5×10-16 | 1.8×10-50 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Ksp只与难溶电解质的性质和温度有关 |
| B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 |
| C.其他条件不变,离子浓度改变时,Ksp不变 |
| D.两种难溶电解质作比较时,Ksp小的,溶解度一定小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.25℃时,Fe(OH)3的溶解度大于Al(OH)3的溶解度 |
| B.25℃时,Fe(OH)3的溶度积大于Al(OH)3的溶度积 |
| C.当生成的Al(OH)3恰好完全溶解时,溶液中的溶质只有NaAlO2 |
| D.图中2a=b=6(c-b) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com