
分析 ①氢氧化钡溶液和硫酸溶液反应生成硫酸钡和水;
②碳酸钙和足量稀盐酸反应生成氯化钙和二氧化碳、水;
③碳酸氢钠和稀盐酸反应生成氯化钙和水、二氧化碳.
解答 解:①氢氧化钡溶液和硫酸溶液反应生成硫酸钡和水,离子方程式:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
故答案为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
②碳酸钙和足量稀盐酸反应生成氯化钙和二氧化碳、水,离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O,
故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;
③碳酸氢钠和稀盐酸反应生成氯化钙和水、二氧化碳,离子方程式为:HCO3-+H+=H2O+CO2↑;
故答案为:HCO3-+H+=H2O+CO2↑.
点评 本题考查了离子方程式的书写,题目难度中等,注意掌握离子方程式的概念、表示意义及书写原则,明确需要保留化学式的物质,如难溶物、弱电解质、氧化物,还要区别离子方程式满足守恒关系,如:质量守恒定律、电荷守恒、电子守恒.


科目:高中化学 来源: 题型:选择题
| A. | 2和3 | B. | 3和2 | C. | 3和1 | D. | 1和3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
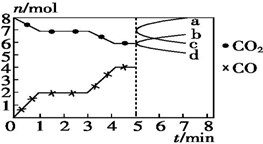 炼铁的还原剂CO是由焦炭和CO2反应而得.现将焦炭和CO2放入体积为2L的密闭容器中,高温下进行下列反应:C(s)+CO2(g)═2CO(g)△H=Q kJ•mol-1.如图为CO2、CO的物质的量n随时间t的变化关系图.下列说法正确的是( )
炼铁的还原剂CO是由焦炭和CO2反应而得.现将焦炭和CO2放入体积为2L的密闭容器中,高温下进行下列反应:C(s)+CO2(g)═2CO(g)△H=Q kJ•mol-1.如图为CO2、CO的物质的量n随时间t的变化关系图.下列说法正确的是( )| A. | 0~1 min,v(CO)=1 mol•L-1•min-1;1~3 min,v(CO)=v(CO2) | |
| B. | 当容器内的压强不变时,反应一定达到平衡状态,$\frac{P(平衡)}{P(起始)}$<1 | |
| C. | 3 min时,温度由T1升高到T2,则Q>0,再达平衡时,$\frac{K({T}_{2})}{K({T}_{1})}$>1 | |
| D. | 5 min时再充入一定量的CO,a、b曲线分别表示n(CO)、n(CO2)的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 浓度(mol/L) | 时间(min) | |||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | |||
| 1 | 温 度 | 800℃ | 1.0 | 0.80 | O.64 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 | |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 | |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe比Cu的金属性强,因此可用FeCl3腐蚀Cu刻制应刷电路板 | |
| B. | 纯碱、小苏打、盐酸分别属于碱、盐、混合物 | |
| C. | 胶体化学是制造纳米材料的有效方法之一 | |
| D. | 用萃取方法分离碘的苯溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 Ca(H2PO2)2(次磷酸钙,一元中强酸H3PO2的钙盐)是一种白色结晶粉末,溶于水(常温时,溶解度16.7g/100g水),其水溶液呈现弱酸性.可用作医药、抗氧化剂以及制备次磷酸钠等.由白磷(P4)与石灰乳制备Ca(H2PO2)2的实验步骤如下:
Ca(H2PO2)2(次磷酸钙,一元中强酸H3PO2的钙盐)是一种白色结晶粉末,溶于水(常温时,溶解度16.7g/100g水),其水溶液呈现弱酸性.可用作医药、抗氧化剂以及制备次磷酸钠等.由白磷(P4)与石灰乳制备Ca(H2PO2)2的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于混合物的是②⑦⑧ | B. | 属于盐的是⑥⑩ | ||
| C. | 属于电解质的是⑤⑥⑦⑩ | D. | 属于分散系的是②⑦⑧⑨ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com