
下列实验过程中反应的离子方程式的书写正确的是()
A. “84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混用会导致氯气中毒:ClO﹣+Cl﹣+2H+═Cl2↑+H2O
B. 水壶中水垢用食醋除去:2H++CaCO3═Ca2++CO2↑+H2O、
C. SO2通入到滴加酚酞的NaOH溶液中,红色变浅:SO2+2NaOH═Na2SO4+H2O
D. 用FeSO4除去酸性废水中的Cr2O72﹣:Cr2O72﹣+Fe2++14H+═2Cr3++Fe3++7H2O
考点: 离子方程式的书写.
分析: A.发生氧化还原反应生成氯气,电子、电荷守恒;
B.醋酸在离子反应中保留化学式;
C.反应生成亚硫酸钠和水;
D.电子、电荷不守恒.
解答: 解:A.“84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混用会导致氯气中毒的离子反应为ClO﹣+Cl﹣+2H+═Cl2↑+H2O,故A正确;
B.水壶中水垢用食醋除去的离子反应为2HAc+CaCO3═Ca2++CO2↑+H2O+2Ac﹣,故B错误;
C.SO2通入到滴加酚酞的NaOH溶液中,红色变浅的离子反应为SO2+2OH﹣═SO32﹣+H2O,故C错误;
D.用FeSO4除去酸性废水中的Cr2O72﹣的离子反应为Cr2O72﹣+6Fe2++14H+═2Cr3++6Fe3++7H2O,故D错误;
故选A.
点评: 本题考查离子反应方程式书写的正误判断,为2015届高考经典题型,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,题目难度不大.


科目:高中化学 来源: 题型:
钒被誉为“合金中的维生素”,钒元素的部分信息如图.下列有关钒的说法正确的是( )
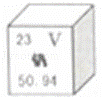
|
| A. | 属于非金属元素 | B. | 原子序数为23 |
|
| C. | 原子核外电子数为28 | D. | 相对原子质量为50.94g |
查看答案和解析>>
科目:高中化学 来源: 题型:
聚乙炔衍生物分子M的结构简式及M在稀硫酸作用下的水解反应如图所示.下列有关说法不正确的是()
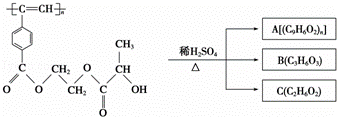
A. M与A均能使酸性高锰酸钾溶液和溴水褪色
B. B中含有羧基和羟基两种官能团,能发生消去反应和酯化反应
C. 1 mol M与热的烧碱溶液反应,可消耗2n mol NaOH
D. A、B、C各1 mol分别与金属钠反应,放出气体的物质的量之比为1:2:2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学与环境的叙述不正确的是()
A. 航天飞机上的隔离陶瓷属于复合材料
B. CO2和NO2是造成酸雨的主要原因
C. 燃煤中加入适量石灰石,可减少废气中SO2的含量
D. 垃圾是放错地方的资源,应分类回收利用
查看答案和解析>>
科目:高中化学 来源: 题型:
将几滴KSCN(SCN﹣是“类卤离子”)溶液加入到含有Fe3+的酸性溶液中,溶液变成红色.将该红色溶液分为两份:①一份中加入适量KMnO4溶液,红色褪去;②向另一份中通入SO2,红色也褪去.下列推测肯定不正确的是()
A. ①中红色褪去的原因是KMnO4将SCN﹣氧化
B. ②中红色褪去的原因是SO2将Fe3+还原为Fe2+
C. ②中红色褪去的原因是SO2将SCN﹣还原
D. SCN﹣在适当条件下可失去电子被氧化为(SCN)2
查看答案和解析>>
科目:高中化学 来源: 题型:
日常生活中使用的铝合金中的铝来自于电解氧化铝.工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为Si02、Fe2O3、Ca0、Mg0、Na20等.工业生产铝锭的工艺流程示意图如下:
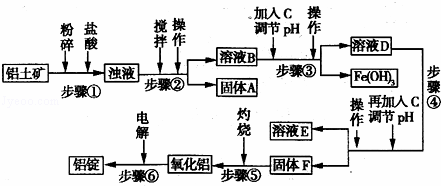
一些氢氧化物沉淀的pH如表:
沉淀物 Al(OH)3 Fe(OH)3 Mg(OH)2
开始沉淀pH(离子初始浓度为0.01mol/L) 4 2.3 10.4
完全沉淀pH(离子初始浓度为<10﹣5mol/L) 5.2 4.1 12.4
请回答下列问题:
(1)实验室进行步骤④的操作名称为 .
(2)固体A的化学式为 ,物质C的化学式为 .
(3)步骤④调节pH的范围为 .
(4)步骤⑥反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
关于小苏打水溶液的表述正确的是( )
|
| A. | c(Na+)=c(HCO3﹣)+c(CO32﹣)+c(H2CO3) |
|
| B. | c(Na+)+c(H+)=c(HCO3﹣)+c(CO32﹣)+c(OH﹣) |
|
| C. | HCO3﹣的电离程度大于HCO3﹣的水解程度 |
|
| D. | 存在的电离有:NaHCO3═Na++HCO3﹣,HCO3﹣═H++CO32﹣,H2O⇌H++OH﹣ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com