
分析 (1)能导电的物质中含有自由移动的阴阳离子或电子,如金属或电解质溶液能导电;
(2)在水溶液里或熔融状态下能导电的化合物是电解质,酸、碱、盐、金属氧化物都属于电解质.
解答 解:①NaCl晶体 ②纯H2SO4 ③CaCO3固体 ④熔融KCl ⑤蔗糖 ⑥铜 ⑦SO2 ⑧KOH固体 ⑨液氧 ⑩稀硫酸
①NaCl晶体属于电解质,但无自由移动离子,不能导电;
②纯H2SO4 属于电解质,但不含自由移动的阴、阳离子,所以不导电;
③CaCO3属于电解质,因为不含自由移动的阴、阳离子,所以不导电;
④熔融KCl属于电解质,因为含有自由移动的阴、阳离子,所以能导电;
⑤蔗糖属于非电解质,不含自由移动的阴阳离子或自由电子,所以不导电;
⑥铜是单质,所以既不是电解质也不是非电解质,因为含有自由移动的电子,所以能导电;
⑦SO2属于非电解质,不含自由移动的阴阳离子或自由电子,所以不导电;
⑧KOH固体属于电解质,但没有自由移动的阴、阳离子,所以不导电;
⑨液氧 不能导电,是单质不是电解质也不是非电解质,
⑩稀硫酸溶液中存在离子能导电,是溶液属于混合物,
(1)能导电的是④⑥⑩;
故答案为:④⑥⑩;
(2)以上物质中属于电解质的是①②③④⑧,故答案为:①②③④⑧.
点评 本题考查了物质的导电性、电解质和非电解质的判断,明确物质导电的原因与电解质和非电解质的关系是解本题关键,注意导电的不一定是电解质,题目难度不大.


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 41.3% | B. | 8.7% | C. | 1.74% | D. | 2.14% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸滴在石灰石上:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 向澄清石灰水中加入盐酸溶液:H++OH-═H2O | |
| C. | 向Ba(OH)2溶液中滴入过量的Na2SO 溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
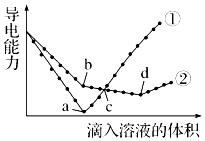 常温下,在两份相同的 Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )
常温下,在两份相同的 Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )| A. | ①代表滴加H2SO4溶液的变化曲线 | B. | b点,水电离产生的c(H+)<10-7mol/L | ||
| C. | c点,两溶液中含有相同量的 OH- | D. | a、d两点对应的溶液均显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系 能量的变化 | ||||
| CO | H2O | CO2 | H2 | |||
| ① | 1 | 4 | 0 | 0 | 放出热量:32.8kJ | |
| A. | 容器①中反应达平衡时,CO的转化率为80% | |
| B. | 平衡时,两容器中CO2的浓度相等 | |
| C. | 容器①中CO的转化率等于容器②中CO2的转化率 | |
| D. | 容器①中CO反应速率等于H2O(g)的反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
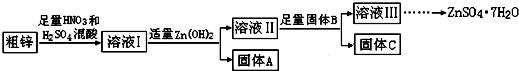
| 物质 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS |
| Ksp | 4.0×10-38 | 5.0×10-20 | 2.0×10-16 | 8.5×10-45 | 1.2×10-23 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com