
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
分析 (1)①根据酸的电离常数进行分析判断,电离常数越大,对应盐的水解程度越小,溶液的pH越小;
②反应后为等浓度的CH3COOH溶液和CH3COONa溶液,醋酸电离程度大于CH3COO-水解程度,故c(CH3COO-)>c(CH3COOH ),溶液呈酸性有c(H+)>c(OH-);
(2)溶度积较大的物质可转化为溶度积较小的物质,平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比值;
(3)相同条件下,气体的体积之比等于物质的量之比,所以一混合气体中NO与NO2的体积比为3:1,则物质的量之比为3:1,设NO、NO2的物质的量分别是3xmol、xmol,n(CH4)=$\frac{22.4L}{22.4L/mol}$=1mol,
NO2完全反应需要n(CH4)=$\frac{1}{4}$×xmol=0.25xmol,同时生成n(NO)=n(NO2)=xmol,则总的n(NO)=4xmol,
NO完全反应需要n(CH4)=xmol,
xmol+0.25xmol=1mol,x=0.8,则NO、NO2的物质的量分别是2.4mol、0.8mol,
NO2完全反应放出的热量为($\frac{574}{4}×0.8$)kJ,
NO完全反应放出的热量=$\frac{3.2△{H}_{2}}{4}$,据此计算△H2.
解答 解:(1)①根据图表数据分析,电离常数:醋酸>HCN>碳酸氢根离子,所以等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液水解程度为:Na2CO3溶液>NaCN溶液>CH3COONa溶液,故溶液的pH为:Na2CO3溶液>NaCN溶液>CH3COONa溶液;故答案为:pH3>pH2>pH1;
②反应后为等浓度的CH3COOH溶液和CH3COONa溶液,醋酸电离程度大于CH3COO-水解程度,故c(CH3COO-)>c(CH3COOH ),溶液呈酸性有c(H+)>c(OH-),
故答案为:>;<;
(2)石膏悬浊液中加入碳酸盐溶液后发生反应的离子方程式为CaSO4+CO32-=CaCO3+SO42-,此温度下该离子反应的平衡常数K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$,
故答案为:CaSO4+CO32-=CaCO3+SO42-;$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$;
(3)相同条件下,气体的体积之比等于物质的量之比,所以一混合气体中NO与NO2的体积比为3:1,则物质的量之比为3:1,设NO、NO2的物质的量分别是3xmol、xmol,n(CH4)=$\frac{22.4L}{22.4L/mol}$=1mol,
NO2完全反应需要n(CH4)=$\frac{1}{4}$×xmol=0.25xmol,同时生成n(NO)=n(NO2)=xmol,则总的n(NO)=4xmol,
NO完全反应需要n(CH4)=xmol,
xmol+0.25xmol=1mol,x=0.8,则NO、NO2的物质的量分别是2.4mol、0.8mol,
NO2完全反应放出的热量为($\frac{574}{4}×0.8$)kJ,
NO完全反应放出的热量=$\frac{3.2△{H}_{2}}{4}$kJ,
放出的总热量=($\frac{574}{4}×0.8$)kJ+$\frac{3.2△{H}_{2}}{4}$kJ=1042.8kJ,
则△H2=-1160kJ/mol,
依据盖斯定律(①+②+③×4)÷2得到:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955 kJ•mol-1;
故答案为:-1160kJ/mol.
点评 本题考查弱电解质的电离、氧化还原反应的计算、盖斯定律等知识点,侧重考查基本理论、计算能力,注意平衡常数K计算时要用浓度而不是物质的量,注意(1)中二氧化氮生成的NO也参加反应,很多同学往往漏掉生成的NO而导致错误,为易错点.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
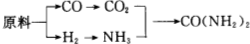

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 用pH计测得次氯酸钠溶液的pH>7 | HClO是弱酸 |
| B | 向10mL0.1 mol/L NaOH溶液中加入1mL 0.1mol/LMgCl2溶液,然后再向混合溶液中 滴加CuCl2溶液,产生蓝色沉淀 | 溶度积:Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| C | 在淀粉溶液中加入稀硫酸,水浴加热,一段 时间后,滴入几滴碘水,溶液变为蓝色 | 淀粉没有水解 |
| D | 在未知溶液中滴加BaCl2溶液出现白色沉淀, 加稀硝酸,沉淀不溶解 | 该未知溶液中存在SO42-或SO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | lmol该有机物可消耗3mol NaOH | B. | 该有机物的分子式为C16H1705 | ||
| C. | 最多可与7molH2发生加成 | D. | 苯环上的一溴代物有6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
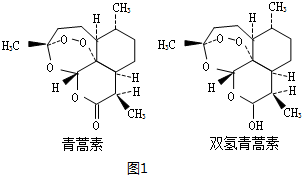
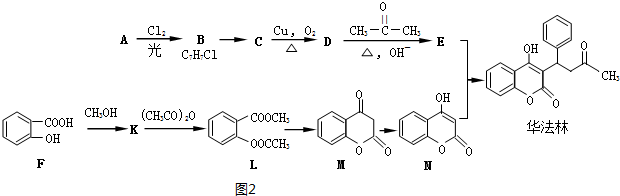
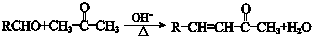
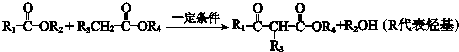
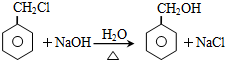 ;
; .L→M的转化中,会产生少量链状高分子聚合物,该聚合物的结构简式为
.L→M的转化中,会产生少量链状高分子聚合物,该聚合物的结构简式为 .
.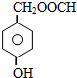 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| m | n | ||
| x | y |
| A. | x最高价氧化对应水化物的碱性比y弱 | |
| B. | m可形成多种氢化物,而n只形成一种氢化物 | |
| C. | x的单质在m的最高价氧化物中燃烧,生成两种固体物质 | |
| D. | m、n两元素所形成的化合物分子中,既含有离子键,也含有共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com