
分析 (1)溶于中残留固体为Fe,硝酸完全反应,Fe与硝酸反应生成Fe(NO3)2NO、NO2,未被还原的硝酸转化为Fe(NO3)2,由Fe原子守恒可知Fe(NO3)2的物质的量,被还原的硝酸转化为NO、NO2,再根据N原子守恒计算;
(2)根据N原子守恒计算HNO3的物质的量,进而计算原HNO3溶液物质的量浓度;
(3)根据总体积、电子转移守恒列方程计算各自物质的量,再根据V=nVm计算体积.
解答 解:(1)溶于中残留固体为Fe,硝酸完全反应,Fe与硝酸反应生成Fe(NO3)2NO、NO2,未被还原的硝酸转化为Fe(NO3)2,
由Fe原子守恒可知n[Fe(NO3)2]=$\frac{10g-4.4g}{56g/mol}$=0.1mol,则n未被还原(HNO3)=2n[Fe(NO3)2]=0.2mol,被还原的硝酸转化为NO、NO2,n被还原(HNO3)=n(NO+)+n(NO2)=$\frac{1.792L}{22.4L/mol}$=0.08mol,故反应中被还原和未被还原的HNO3的物质的量之比为:0.08mol:0.2mol=2:5,
答:反应中被还原和未被还原的HNO3的物质的量之比为2:5.
(2)根据N原子守恒,n(HNO3)=n未被还原(HNO3)+n被还原(HNO3)=0.2mol+0.08mol=0.28mol,则原HNO3溶液物质的量浓度为$\frac{0.28mol}{0.04L}$=7mol/L,
答:原HNO3溶液物质的量浓度为7mol/L.
(3)令混合气体中NO为xmol,NO2为ymol,
则有:$\left\{\begin{array}{l}{x+y=0.08}\\{3x+y=0.1×2}\end{array}\right.$
解得x=0.06、y=0.02
故标况下V(NO)=0.06mol×22.4L/mol=1.344L
V(NO2)=0.02mol×22.4L/mol=0.448L
答:标况下得到NO体积为1.344L,NO2体积为0.448L.
点评 本题考查化学方程式的有关计算、氧化还原反应计算,题目难度中等,注意从守恒的角度解答.


科目:高中化学 来源: 题型:填空题
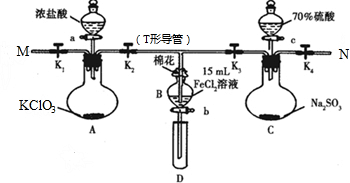
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ | ⑨ |
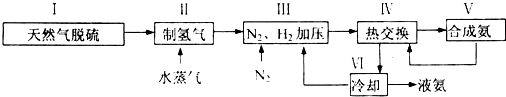
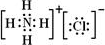 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、H+、SO32-、ClO- | B. | Na+、Cu2+、Cl-、SO42- | ||
| C. | Pb2+、NH4+、Cl-、CH3CHOO- | D. | K+、Fe3+、NO3-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5 mol NO2与足量的H2O反应,转移的电子数为NA | |
| B. | 常温常压下,0.5NA个CO2分子质量为22 g | |
| C. | 28 g氮气所含的原子数目为NA | |
| D. | 在标准状况下,0.5NA个氯气分子所占体积是11.2 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,写出再生反应的化学方程式:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S;NH3的沸点高于H2S,是因为NH3分子之间存在着一种叫氢键的作用力.
,写出再生反应的化学方程式:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S;NH3的沸点高于H2S,是因为NH3分子之间存在着一种叫氢键的作用力.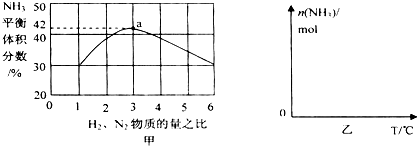
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
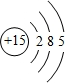 ,E的最高价含氧酸的化学式HClO4.
,E的最高价含氧酸的化学式HClO4.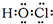 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Z、Q、R、T为前四周期元素,且原子序数依次增大.X和Q属同族元素,X和R可形成化合物XR4;R2为黄绿色气体;Z与X同周期且基态原子的s轨道和p轨道的电子总数相等;T2+的3d 轨道中有5个电子.请回答下列问题:
X、Z、Q、R、T为前四周期元素,且原子序数依次增大.X和Q属同族元素,X和R可形成化合物XR4;R2为黄绿色气体;Z与X同周期且基态原子的s轨道和p轨道的电子总数相等;T2+的3d 轨道中有5个电子.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com