
分析 (1)发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑,根据方程式计算2片小苏打片和胃酸完全反应被反应(中和)的氢离子的物质的量;
(2)计算1片小苏打可以中和氢离子物质的量,再根据Al(OH)3+3HCl=AlCl3+3H2O计算氢氧化铝消耗氢离子的物质的量,最后根据消耗的氢离子的物质的量之比计算1片小苏打片相当于胃舒平的片数;
(3)加入盐酸生成二氧化碳,可知该药物为铝和镁的碱式碳酸盐,反应过程为:先发生H++OH-═H2O,再发生CO32-+H+═HCO3-,最后发生HCO3-+H+═CO2↑+H2O,从42.5mL~45.0mL消耗2.5mL盐酸,发生反应HCO3-+H+═CO2↑+H2O,根据方程式计算n(HCO3-)、n(CO32-),进而计算HCO3-、CO32-消耗的氢离子物质的量,进而计算n(OH-),据此解答.
解答 解:(1)2片小苏打片中含有碳酸氢钠的质量为:0.42g×2=0.84g,
设被中和的HCl物质的量为n(HCl),
NaHCO3 +HCl=NaCl+H2O+CO2↑
84g 1mol
0.84g n(HCl)
n(HCl)=$\frac{1mol×0.84g}{84g}$=0.01mol,
则n(H+)=n(HCl)=0.01mol,
答:被反应(中和)的氢离子的物质的量为0.012;
(2)0.234g氢氧化铝的物质的量为:$\frac{0.234g}{78g/mol}$=0.003mol,
1片小苏打可以中和氢离子物质的量=0.01mol×$\frac{1}{2}$=0.005mol,即可以中和HCl为0.005mol,
Al(OH)3+3HCl=AlCl3+3H2O
1 3
0.003 x
x=$\frac{0.003mol×3}{1}$=0.009mol
1片小苏打片相当于胃舒平的片数为:$\frac{0.005mol}{0.009mol}$=0.56,
答:1片小苏打片相当于胃舒平0.56片;
(3)加入盐酸生成二氧化碳,可知该药物为铝和镁的碱式碳酸盐,反应过程为:先发生H++OH-═H2O,再发生CO32-+H+═HCO3-,最后发生HCO3-+H+═CO2↑+H2O,
从42.5mL~45.0mL消耗2.5mL盐酸,其物质的量=0.0025L×2mol/L=0.005mol,则:
HCO3-+H+═CO2↑+H2O,
0.005mol 0.005mol
CO32-+H+═HCO3-
0.005mol 0.005mol 0.005mol
故与氢氧根反应的氢离子的物质的量为:0.045L×2mol/L-0.005mol-0.005mol=0.08mol,则:
H++OH-═H2O
0.08mol 0.08mol
故该碱式盐样品中氢氧根与碳酸根的物质的量之比为:0.08mol:0.005mol=16:1,
答:该碱式盐样品中氢氧根与碳酸根的物质的量之比为16:1.
点评 本题考查化学方程式的基本计算,题目难度中等,解答关键是正确写出化学方程式,试题体现了化学在生活中的应用,有利于培养学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{18}^{35}$Cl- | B. | ${\;}_{17}^{35}$Cl | C. | ${\;}_{19}^{35}$Cl- | D. | ${\;}_{17}^{35}$Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
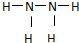 ,过氧化氢的电子式
,过氧化氢的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 ,C的化学式Cl2.
,C的化学式Cl2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知t℃、p kPa时,在容器甲和容器乙中分别充入1 mol A(g)和1 mol B(g),发生反应A(g)+B(g)?C(g)△H<0,反应过程中温度保持不变.已知起始时V乙=$\frac{5}{7}$V甲,装置如图所示,当反应达平衡时,测得甲中C的体积分数为40%,下列说法不正确的是( )
已知t℃、p kPa时,在容器甲和容器乙中分别充入1 mol A(g)和1 mol B(g),发生反应A(g)+B(g)?C(g)△H<0,反应过程中温度保持不变.已知起始时V乙=$\frac{5}{7}$V甲,装置如图所示,当反应达平衡时,测得甲中C的体积分数为40%,下列说法不正确的是( )| A. | 容器甲乙中反应的平衡常数相等 | |
| B. | 容器甲乙中反应的起始速率不等 | |
| C. | 达平衡时,容器甲、乙中各组分的体积分数不等 | |
| D. | 达平衡时,容器甲、乙中放出的热量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=6的H2S溶液中,c(H+)=c(HS-)=1×10-6mol•L-1 | |
| B. | pH=a的醋酸溶液,稀释10倍后,其pH=b,则b=a+1 | |
| C. | pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合后,溶液pH<7:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | pH相同的①CH3COONa、②Na2CO3、③NaClO三种溶液的c(Na+):①<②<③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| 第一组 | Na2CO3 | H2SO4 | NaHCO3 | CaO | CO2 |
| 第二组 | NaOH | HCl | NaCl | Na2O | SO2 |
| 第三组 | NaOH | CH3COOOH | CaF2 | Al2O3 | SO2 |
| 物质 | M | N | Q | P |
| 反应前质量(g) | 50 | 1 | 3 | 12 |
| 反应后质量(g) | X | 26 | 3 | 30 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com