
| A. | 麦芽糖水解的产物只有葡萄糖 | |
| B. | 苯酚可用于合成高分子化合物 | |
| C. | 油脂水解可以制取高级脂肪酸 | |
| D. | 鸡蛋清遇醋酸铅后产生的沉淀能重新溶于水 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
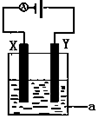 (1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6 kJ/mol
(1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6 kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:解答题
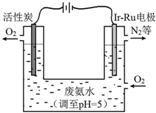 过氧化氢(H2O2)是淡蓝色的黏稠液体,水溶液为无色透明液体,俗称双氧水,可以看作二元弱酸.
过氧化氢(H2O2)是淡蓝色的黏稠液体,水溶液为无色透明液体,俗称双氧水,可以看作二元弱酸.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
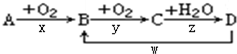
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

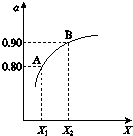

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和汽油都是可再生能源,所以要大力发展“乙醇汽油” | |
| B. | 甲基丙烯酸甲酯可以发生加成、水解和氧化反应 | |
| C. | 苯和苯甲酸的混合物1mol,完全燃烧消耗O2的分子数为7.5NA | |
| D. | 乙苯能被酸性KMnO4溶液氧化,是因为苯环对侧链上的-CH2-产生了影响,使其变活泼 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com