
| A. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液中;c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3mol•L-1 | |
| B. | 常温下,pH=6的NaHSO3溶液中:c(SO32-)-c(H2SO3)=9.9×10-7mol•L-1 | |
| C. | NH4HSO3溶液中滴加NaOH至溶液恰好呈中性:c(Na+)>c(SO42-)=c(NH4+)>c(OH-)=c(H+) | |
| D. | 等浓度、等体积的Na2CO3和NaHCO3混合:$\frac{c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$>$\frac{c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})}$ |
分析 A.亚铁离子会水解生成氢氧化亚铁;
B.根据溶液中的电荷守恒和物料守恒分析.
C.根据物料守恒可知,c(SO42-)=c(NH4+)+c(NH3•H2O);
D.CO32-的水解程度大于HCO3-.
解答 解:A.亚铁离子会水解生成氢氧化亚铁,所以亚铁离子浓度会减小,则c(NH4+)+c(NH3•H2O)+c(Fe2+)<0.3mol•L-1,故A错误;
B.常温下,pH=6的NaHSO3溶液中,电荷守恒为c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),物料守恒为c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),所以溶液中存在c(SO32-)-c(H2SO3)=c(H+)-c(OH-)=9.9×10-7mol•L-1,故B正确.
C.由物料守恒可知,c(SO42-)=c(NH4+)+c(NH3•H2O),所以c(SO42-)>c(NH4+),故C错误;
D.CO32-的水解程度大于HCO3-,则等浓度、等体积的Na2CO3和NaHCO3混合:$\frac{c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$>1,$\frac{c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})}$<1,所以$\frac{c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$>$\frac{c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})}$,故D正确.
故选BD.
点评 本题考查了盐的水解、离子浓度大小比较,题目难度中等,注意把握溶液中的电荷守恒和物料守恒,侧重于考查学生的分析能力.


科目:高中化学 来源: 题型:解答题
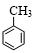 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$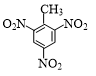 +3H2O.
+3H2O.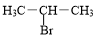 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$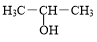 +NaBr.
+NaBr.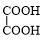 +
+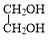 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火时使用泡沫灭火器灭火 | |
| B. | 明矾常用于水体的净化、杀菌和消毒 | |
| C. | 热的纯碱溶液去污效果更好 | |
| D. | 84消毒液与洁厕灵混合后用于清洁洗手间的效果更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 82克O2所含有的原子数目为NA | |
| B. | 0.5molH2O含有的原子数目为1.5NA | |
| C. | 1molH2O含有的H2O分子数目为NA | |
| D. | 0.5NA个氯气分子的物质的量是0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{{K}_{w}}{c(O{H}^{-})}$=0.1mol•L-1的溶液:Na+、K+、SiO32-、NO3- | |
| B. | 遇苯酚显紫色的溶液:I-、K+、SCN-、Mg2+ | |
| C. | 与铝反应产生大量氢气的溶液:NH4+、Na+、CO32-、NO3- | |
| D. | 加入NaOH后加热既有气体放出又有沉淀生成的溶液:Ca2+、HCO3-、NH4+、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
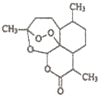 中国药学家屠呦呦因最早发现并提纯抗疟新药青蒿素而获得2015年度诺贝尔生理学或医学奖.已知青蒿素可从与青蒿同属的黄花蒿中提取,其结构如图所示,下列有关青蒿素说法不正确的是( )
中国药学家屠呦呦因最早发现并提纯抗疟新药青蒿素而获得2015年度诺贝尔生理学或医学奖.已知青蒿素可从与青蒿同属的黄花蒿中提取,其结构如图所示,下列有关青蒿素说法不正确的是( )| A. | 化学式为C15H20O5 | |
| B. | 能与NaOH溶液发生反应 | |
| C. | 与H2O2含有相似结构,具有杀菌作用 | |
| D. | 提取方法主要是低温萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 1:4 | C. | 1:5 | D. | 1:6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com