
科目:高中化学 来源:2016届山东省青岛市高三上学期期中测试化学试卷(解析版) 题型:选择题
下列关于胶体的说法正确的是
A.将可见光通过胶体出现“光路”是因为发生了光的折射
B.胶体能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
C.稀豆浆、硅酸、氯化铁溶液均为胶体
D.向沸水中逐滴加入少量饱和FeCl3溶液,继续加热搅拌可制得Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期半期考试化学试卷(解析版) 题型:填空题
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
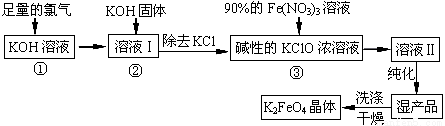
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH 与Cl2 反应生成的是KClO3。写出在温度较高时KOH 与Cl2反应的化学方程式 ,当反应中转移5 mol电子时,消耗的氯气是 mol。
(2)在反应液I中加入KOH固体的目的是 (填编号)。
A.与反应液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3 、KCl,则反应③中发生的离子反应方程式为 。
(4)如何判断K2FeO4晶体已经洗涤干净 。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,其离子反应是:
FeO42? + H2O = Fe(OH)3(胶体) + O2↑ +
完成并配平上述反应的离子方程式。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江哈尔滨附属中学高二上期中化学试卷(解析版) 题型:选择题
某温度下,在一个2L的密闭容器中加入4molA和2molB进行如下反应:
3A(g) + 2B(g)  4C(s) + D(g),反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是
4C(s) + D(g),反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是
A.该反应的平衡表达式是

B.B的平衡转化率是40%
C.增大该体系的压强,平衡不移动,化学平衡常数不变
D.增加B,平衡正向移动,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上11月月考化学试卷(解析版) 题型:填空题
2008年9月25日21时10分,我国在酒泉卫星发射基地成功发射神舟七号宇宙飞船,实现了中国航天航空史上的伟大突破。承载神舟七号升空任务的是长征二号F型火箭,其第一节、第二节、第三节均以液态四氧化二氮(N2O4)和联氨(N2H4)为原料,使后者在前者中燃烧,产生巨大的推动力助火箭升空,最终产物是N2和H2O。
(1)请写出该反应的化学方程式_______________________;
(2)反应中氧化剂是____________________;
(3)该反应属于_______________(填“放热反应”或“ 吸热反应”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一上11月月考化学试卷(解析版) 题型:选择题
下列反应中Na2O2,只表现强氧化性的是
A.2Na2O2+2H2O=4NaOH+O2↑
B.Na2O2+MnO2=Na2MnO4
C.2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑
D.5Na2O2+2KMnO4+8H2SO4=5Na2SO4+K2SO4+2MnSO4+8H2O+5O2↑
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一上期中测试化学试卷(解析版) 题型:选择题
下列化学反应中,属于氧化还原反应的是
A.CuSO4 + 2NaOH = Cu(OH) 2↓+ Na2SO4
B.Al2O3 + 6HCl=2AlCl3 + 3H2O
C.Ca(ClO)2 + CO2 + H2O = CaCO3↓+ 2HClO
D.2Na2O2 + 2CO2 =2Na2CO3 + O2
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三上学期10月月考化学试卷(解析版) 题型:选择题
将35g锌粉与少量浓硫酸在加热条件下充分反应,共收集到混合气体11.2L(标准状况),其质量为19.6g,则剩余锌粉的质量为
A.1.0g B.2.0g C.2.5g D.3.5g
查看答案和解析>>
科目:高中化学 来源:2016届河南省顶级名校高三上学期期中测试化学试卷(解析版) 题型:填空题
乙苯催化脱氢制苯乙烯反应: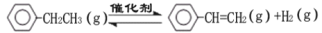
(1)已知:
化学键 | C-H | C-C | C=C | H-H |
键能/kJ·molˉ1 | 412 | 348 | 612 | 436 |
计算上述反应的△H=__________。
(2)维持体系总压强p恒定,在温度T时,物质的量为n的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的压强平衡常数Kp=___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)工业上,通常在乙苯蒸汽中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
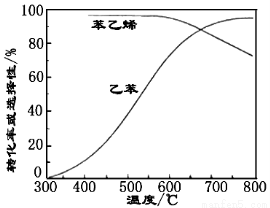
① 掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实___________。
② 控制反应温度为600℃的理由是____________。
(4)某研究机构用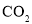 代替水蒸气开发了绿色化学合成工艺——乙苯-二氧化碳耦合催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;已知该工艺中还能够发生反应:
代替水蒸气开发了绿色化学合成工艺——乙苯-二氧化碳耦合催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;已知该工艺中还能够发生反应: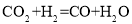 ,
, ,据此可推知新工艺的特点有_________(填编号)。
,据此可推知新工艺的特点有_________(填编号)。
① 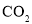 与
与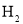 反应,使乙苯脱氢反应的化学平衡右移
反应,使乙苯脱氢反应的化学平衡右移
② 不用高温水蒸气,可降低能量消耗
③ 有利于减少积炭
④ 有利用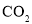 资源利用
资源利用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com