
向一洁净干燥的烧杯中加入44.4gAl粉与Fe粉混合物,然后加入过量的盐酸,产生标况下气体26.88L。若将该混合物加入500mL14 mol·L-1的HNO3中(不考虑发生钝化),产生的气体(标准状况下测定)如图所示,假设HNO3的还原产物为NO与NO2,那么理论上从哪一时刻开始产生NO气体?(假设浓度小于9mol/L为稀HNO3)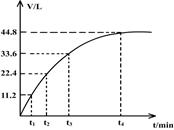
| A.t1 | B.t2 | C.t3 | D.t4 |
C
解析试题分析:由Al粉与Fe粉的混合物共44.4g,与过量盐酸反应产生标况下 气体26.88L,根据得失电子守恒可以计算出Al与Fe分别是0.4mol、0.6mol,将该混合物加入500mL14 mol·L-1的HNO3中,若金属全部生成+3价硝酸盐,则未被还原的硝酸的物质的量为3mol,被还原的硝酸的物质的量由图中的气体体积可知是2mol,所以共消耗硝酸3+2=5mol<0.5ml×14 mol·L-1=7mol,硝酸过量,固体全部溶解。设气体产物中NO与NO2的物质的量分别为x、ymol,根据得失电子守恒可得,3x+y=(0.4+0.6)×3,x+y=2,解得x=0.5,y=1.5,1.5mol×22.4L/mol=33.6L,所以理论上在t3时刻开始产生NO气体,答案选C。 考点:考查氧化还原反应中得失电子守恒规律的应用
考点:考查氧化还原反应中得失电子守恒规律的应用


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:单选题
按要求写出下列反应的化学方程式
(1)短周期元素组成的三种有色物质(单质或化合物)可以与水发生氧化还原反应,水既不是氧化剂也不是还原剂,按相对分子质量由小到大的顺序写出三种物质与水反应的方程式。
①
②
③
(2)由短周期元素构成的两种单质与水发生氧化还原反应
④水只作氧化剂
⑤水只作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某含铬Cr2O72-废水用硫酸亚铁铵[FeSO4·(NH4)2 SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀干燥后得到n molFeO·FeyCrxO3,其中Cr的化合价为+3价。不考虑处理过程中的实际损耗,下列叙述错误的是
| A.消耗硫酸亚铁铵的物质的量为n(2-x)mol |
B.处理废水中Cr2O72- 的物质的量为 mol mol |
| C.反应中转移的电子为3nx mol |
| D.在FeO·FeyCrxO3中3x=y |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法中正确的是( )
| A.含有金属元素的离子一定是阳离子,金属阳离子被还原一定得到金属单质 |
| B.pH相等的NaOH、NaHCO3和Na2CO3三种溶液: c(NaOH)<c(NaHCO3)<c(Na2CO3) |
| C.常温下,c(NH4+)相等的4种溶液:①(NH4)2SO4②(NH4)2Fe(SO4)2③NH4Cl ④(NH4)2CO3,溶质物质的量浓度大小关系是:②<①<④<③ |
| D.某温度时水的离子积常数KW=10-13若将此温度下pH=11的NaOH溶液aL与pH=1的稀硫酸bL混合,若所得混合液pH=2,则a:b=2:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
三氟化氮(NF3)在微电子工业中有重要用途,可由氨气和氟气反应得到,它在潮湿的空气中与水蒸气反应的产物有HF、NO和HNO3。下列说法错误的是
| A.原子半径:N>F |
| B.在与水蒸气反应中,NF3既是氧化剂又是还原剂 |
| C.若NF3泄漏,可用石灰水溶液喷淋的方法减少污染 |
| D.在潮湿空气中反应,被氧化与被还原的元素的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为( )
| A.1:4 | B.1:2 | C.2:1 | D.4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知NH4CuSO3与足量的2 mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是( )
| A.反应中硫酸做氧化剂 |
| B.NH4CuSO3中硫元素被氧化 |
| C.1 mol NH4CuSO3完全反应转移0.5 mol电子 |
| D.刺激性气味的气体是氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
LiAlH4是重要的储氢材料,其组成类似于Na3AlF6。常见的供氢原理如下面两个方程式所示:
①2LiAlH4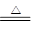 2LiH+2Al+3H2↑
2LiH+2Al+3H2↑
②LiAlH4+2H2O=LiAlO2+4H2↑
下列说法正确的是( )
| A.LiAlH4是共价化合物,LiH是离子化合物 |
| B.生成等质量的氢气,反应①、②转移电子数之比为4?3 |
| C.氢化锂也是一种储氢材料,供氢原理为LiH+H2O=LiOH+H2↑ |
| D.若反应①中生成3.36 L氢气,则一定有2.7 g铝生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3—、N2、Cl-六种物质。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是( )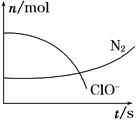
| A.还原剂是含CN-的物质,氧化产物只有N2 |
| B.氧化剂是ClO- , 还原产物是HCO3— |
| C.配平后氧化剂与还原剂的化学计量数之比为5∶2 |
| D.若生成2.24 L N2(标准状况),则转移电子0.5 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com