
| 物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
| 溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
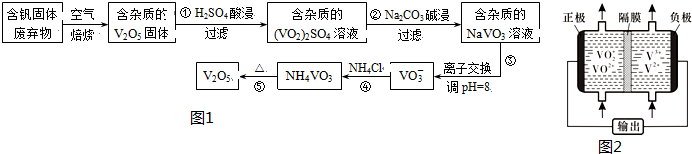
分析 反应①用硫酸溶解含钒固体废弃物(含有SiO2、Al2O3及其他残渣),生成(VO2)2SO4和硫酸铝,SiO2等不溶性杂质过滤除去;反应②是用碳酸钠溶液与(VO2)2SO4和硫酸铝反应,与(VO2)2SO4反应生成NaVO3,碳酸根离子与铝离子水解相互促进生成Al(OH)3沉淀;反应④是NaVO3溶液与氯化铵反应生成NH4VO3沉淀,加热NH4VO3分解为V2O5,据此解答(1)(2)(3);
(4)据已知热化学方程式和待求热化学方程式,利用盖斯定律计算;
(5)钒液流电池放电时负极发生氧化反应,正极发生还原反应,充电时,阳极发生氧化反应;
(6)先据反应方程式和滴定数据计算(VO2)2SO4溶液中c(VO2+)的物质的量浓度,再计算该(VO2)2SO4溶液中钒的含量.
解答 解:(1)用硫酸溶解含钒固体废弃物(含有SiO2、Al2O3及其他残渣),生成(VO2)2SO4和硫酸铝,溶液中的阳离子除氢离子外还有VO2+和Al3+,
故答案为:VO2+和Al3+;
(2)含杂质的(VO2)2SO4溶液用碳酸钠溶液碱浸生成含杂质的NaVO3溶液,Al(OH)3不溶于弱碱,所以反应②碱浸后滤出的固体主要成分是Al(OH)3,
故答案为:Al(OH)3;
(3)据工艺流程图可知,反应④的离子方程式为VO3-+NH4+=NH4VO3,故答案为:VO3-+NH4+=NH4VO3↓;
(4)已知①4Al(s)+3O2(g)═2Al2O3(s)△H1=-a kJ/mol
②4V(s)+5O2(g)═2V2O5(s)△H2=-b kJ/mol
据盖斯定律,(①×5-②×3)÷2得:10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s)△H=-$\frac{5a-3b}{2}$KJ/mol,
故答案为:10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s)△H=-$\frac{5a-3b}{2}$KJ/mol;
(5)钒液流电池放电时负极发生氧化反应,据图可知,电极反应式为V2+-e-=V3+,正极发生还原反应,充电时,阳极发生氧化反应,电极反应式为VO2+-e-+H2O=VO2++2H+;故答案为:V2+-e-=V3+;VO2+-e-+H2O=VO2++2H+;
(6)据滴定数据,结合离子方程式c(VO2+)=$\frac{2×25.0mL×0.100mol/L}{24.0mL}$=0.2083mol/L,所以1L溶液中含V的质量为0.2083mol/L×1L×51g/mol=10.6g,
故答案为:10.6.
点评 本题通过从含钒固体废弃物(含有SiO2、Al2O3及其他残渣)中提取钒的一种新工艺主要流程考查了氢氧化铝的两性、离子方程式书写、盖斯定律、电极反应式书写以及物质含量的计算,题目难度较大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 只能是7 | B. | 只能是15 | C. | 是11或15 | D. | 是11或13 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H20
+H20| 相对分子质量 | 密度(g/cm3) | 沸点(℃) | 水中溶解性 | |
| 正丁酸 | 88 | 0.9587 | 163.5 | 溶 |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 丁酸异戊酯 | 158 | 0.886 | 179 | 不溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +NaCl+3H2O.
+NaCl+3H2O. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CO的应用和治理是当今社会的热点问题.
CO的应用和治理是当今社会的热点问题.| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com