
| A. | ②⑤ | B. | ①②③ | C. | ⑤ | D. | ③④⑤⑥ |
分析 强弱电解质的根本区别是电离程度,部分电离的电解质是弱电解质,要证明醋酸是弱电解质,只要证明醋酸部分电离即可,可以根据醋酸钠溶液酸碱性、一定浓度的醋酸pH等方法判断,据此分析解答.
解答 解:A.①0.1mol/L的CH3COOH溶液的pH=2.1,说明醋酸没有完全电离,则醋酸为弱电解质,故不选;
②CH3COONa和盐酸反应,生成CH3COOH,说明盐酸的酸性比醋酸强,则醋酸为弱酸,即醋酸为弱电解质,故不选;
③等pH等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多,说明醋酸中存在电离平衡,则醋酸部分电离为弱电解质,故不选;
④常温下某CH3COONa溶液的pH=8,说明醋酸钠是强碱弱酸盐,则醋酸为弱酸,故不选;
⑤用CH3COOH溶液做导电实验,灯泡很暗,说明醋酸溶液中离子浓度较小,不能说明醋酸部分电离,所以不能证明醋酸是弱电解,故选;
⑥pH=1的CH3COOH溶液稀释100倍,pH<3,说明醋酸中存在电离平衡,为弱电解质,故不选;
故选C.
点评 本题考查强弱电解质判断,题目难度不大,明确强弱电解质根本区别是解本题关键,注意不能根据电解质溶液导电性强弱、电解质溶解性强弱等方法判断,为易错题.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 闪电时,N2变为NO | B. | NO被空气中O2氧化为NO2 | ||
| C. | 工业上,用N2合成氨 | D. | 豆科植物根瘤菌把N2变成NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
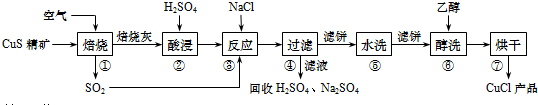
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
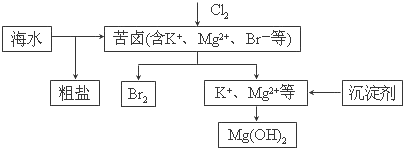
| A. | 向苦卤中通入Cl2是为了提取溴 | |
| B. | 粗盐可采用除杂和重结晶等过程提纯 | |
| C. | 工业生产中常选用NaOH作为沉淀剂 | |
| D. | 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其氧化吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
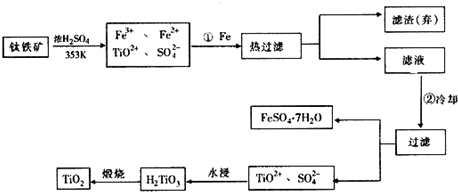
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| B. | 碳酸氢钙与过量的NaOH溶液反应:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| C. | 用稀硝酸除去试管内壁银:Ag+2H++NO3-═Ag++NO2↑+H2O | |
| D. | 向氨水中通入过量SO2:SO2+2NH3•H2O═2NH4++SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe在少量Cl2中燃烧生成0.5 mol 产物,转移的电子数为1 NA | |
| B. | 78g Na2O2晶体中含有的阴离子数目为2NA | |
| C. | 在标准状况下,2.8g N2和2.8g CO所含电子数均为1.4NA | |
| D. | pH=13的NaOH溶液中含有的OH-的数目为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
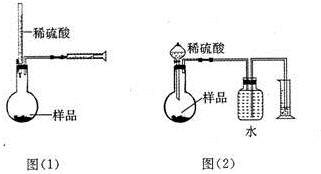 为测定NaOH、Na2C03混合物中Na2C03的质量分数,甲同学拟采用图(1)所示装置来测定.乙同学拟采用图(2)所示装置来测定.
为测定NaOH、Na2C03混合物中Na2C03的质量分数,甲同学拟采用图(1)所示装置来测定.乙同学拟采用图(2)所示装置来测定.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水得氯水,该溶液能导电,因此氯气是电解质 | |
| B. | CaCO3饱和溶液导电能力很弱,故CaCO3是弱电解质 | |
| C. | HF的水溶液中既有H+、F-,又有大量的HF分子,因此HF是弱电解质 | |
| D. | 导电能力弱的溶液肯定是弱电解质的溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com