
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
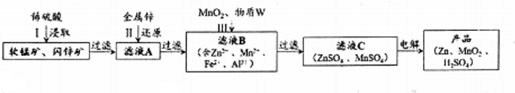
分析 软锰矿、闪锌矿和稀硫酸混合,发生的反应有MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O、MnO2+FeS+2H2SO4=MnSO4+FeSO4+S↓+2H2O、MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+CdS+2H2SO4=MnSO4+CdSO4+S↓+2H2O、Al2O3+3H2SO4═Al2(SO4)3+3H2O,二氧化硅不溶于稀硫酸,然后过滤,滤液中含有MnSO4、FeSO4、CuSO4、CdSO4、Al2(SO4)3,向滤液中加入Zn,Zn能还原Cu2+、Cd2+得到Cu、Cd,过滤向滤液中加入二氧化锰和W,二氧化锰具有氧化性,能氧化还原性离子Fe2+,W能使溶液中铁离子、铝离子反应生成沉淀,则W能和氢离子反应且不能引进新的杂质;电解硫酸锌和硫酸锰溶液得到Zn、MnO2和稀硫酸;
(1)Al2O3是两性氧化物,能和H2SO4反应生成Al2(SO4)3和 H2O;
(2)根据流程图中反应前后离子变化确定回收金属成分;
(3)二氧化锰具有氧化性,能氧化还原性离子;
W能和氢离子反应而调节溶液的pH,且不能引进新的杂质;
(4)放电时负极上锌失电子发生氧化反应;
(5)根据盖斯定律写出该反应热化学方程式;
(6)闪锌矿浸取后m(Zn)=100t×80%×(1-97%)×$\frac{65}{97}$=52t,电解反应式为Zn 2++Mn 2++2H2O$\frac{\underline{\;电解\;}}{\;}$Zn↓+MnO2↓+4H+,根据方程式中锌元素和二氧化锰之间的关系式计算需要Zn的质量.
解答 解:软锰矿、闪锌矿和稀硫酸混合,发生的反应有MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O、MnO2+FeS+2H2SO4=MnSO4+FeSO4+S↓+2H2O、MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+CdS+2H2SO4=MnSO4+CdSO4+S↓+2H2O、Al2O3+3H2SO4═Al2(SO4)3+3H2O,二氧化硅不溶于稀硫酸,然后过滤,滤液中含有MnSO4、FeSO4、CuSO4、CdSO4、Al2(SO4)3,向滤液中加入Zn,Zn能还原Cu2+、Cd2+得到Cu、Cd,过滤向滤液中加入二氧化锰和W,二氧化锰具有氧化性,能氧化还原性离子Fe2+,W能使溶液中铁离子、铝离子反应生成沉淀,则W能和氢离子反应且不能引进新的杂质;电解硫酸锌和硫酸锰溶液得到Zn、MnO2和稀硫酸;
(1)Al2O3是两性氧化物,能和H2SO4反应生成Al2(SO4)3和 H2O,反应方程式为Al2O3+3H2SO4═Al2(SO4)3+3H2O,
故答案为:Al2O3+3H2SO4═Al2(SO4)3+3H2O;
(2)根据流程图中反应前后离子变化确定回收金属成分为Cu、Cd,故答案为:Cu、Cd;
(3)二氧化锰具有氧化性,能氧化还原性离子亚铁离子,然后将铁离子除去;
W能和氢离子反应而调节溶液的pH,且不能引进新的杂质,符合条件的有BD,一水合氨和NaOH虽然能调节溶液的pH但引进新的杂质,
故答案为:将Fe2+氧化成Fe3+;BD;
(4)放电时负极上锌失电子发生氧化反应,电极反应式为Zn-2e-═Zn2+,故答案为:Zn-2e-═Zn2+;
(5)Mn(s)+O2(g)=MnO2(s)△H1=-520kJ•mol-1 ①
C(s)+O2(g)=CO2(g)△H2=-393.5kJ•mol-1 ②
2Mn(s)+2C(s)+3O2(g)=2MnCO3(s)△H3=-894kJ•mol-1③,
将方程式;2(①+②)-③得2MnCO3(s)+O2(g)═2MnO2(s)+2CO2(g)△H=2(-520kJ•mol-1-393.5kJ•mol-1 )-(-894kJ•mol-1)=-933 kJ•mol-1,
故答案为:2MnCO3(s)+O2(g)═2MnO2(s)+2CO2(g)△H=-933 kJ•mol-1;
(6)闪锌矿浸取后m(Zn)=100t×80%×(1-97%)×$\frac{65}{97}$=52t,电解反应式为Zn 2++Mn 2++2H2O$\frac{\underline{\;电解\;}}{\;}$Zn↓+MnO2↓+4H+,
设生成87t二氧化锰所需锌元素质量为x,
Zn 2++Mn 2++2H2O$\frac{\underline{\;电解\;}}{\;}$Zn↓+MnO2↓+4H+
65 87
x 87t
65:87=x:87t
x=$\frac{65×87t}{87}$=65t
实际上有52t,则还需要65t-52t=13t,
故答案为:13.
点评 本题考查物质分离和提纯,为高频考点,涉及化学方程式的计算、原电池原理、盖斯定律、除杂等知识点,侧重考查学生分析计算及知识的综合运用,明确化学原理、各个物理量之间的关系及流程图中发生的反应及可能存在的离子或物质是解本题关键,题目难度中等.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:选择题
| A. | 2 mol HI(g) | B. | 2 mol H2(g)和1 mol I2(g) | ||
| C. | 1 mol H2(g)和2 mol I2(g) | D. | 1 mol I2(g)和2 mol HI(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ③
③ .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Co2+ | 7.2 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/(s) | 0 | 0.01 | 0.02 | 0.03 | 0.04 |
| (CrO42-)/(mol•L-1) | 0.20 | 1.6×10-2 | 1.2×10-2 | 1.0×10-2 | |
| (Cr2O72-)/(mol•L-1) | 0 | 9.2×10-2 | 9.4×10-2 | 9.5×10-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
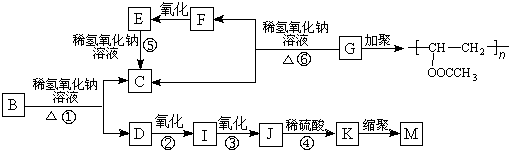
 .
.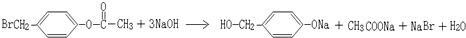 ,K与少量的氢氧化钠溶液反应:
,K与少量的氢氧化钠溶液反应: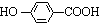 +NaOH→
+NaOH→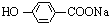 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
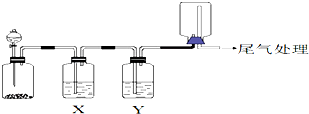
| 选项 | 实验目的 | X中试剂 | Y中试剂 |
| A | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
| B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
| C | CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
| D | 氨水与生石灰反应制取并收集纯净干燥的NH3 | 饱和NaOH溶液 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com