
分析 H原子物质的量为H3PO4的3倍,而H原子物质的量等于HNO3的物质的量;
H3PO4、H2SO4分子均含有4个O原子,含有氧原子数目相等,则二者物质的量相等,根据N=nNA计算H2SO4分子数目;
分子数目相同,则物质的量相同;
结合化学式含有原子数目计算氨气分子物质的量.
解答 解:与0.2mol H3PO4有相同H原子数的HNO3为$\frac{0.2mol×3}{1}$=0.6mol;
H3PO4、H2SO4分子均含有4个O原子,含有氧原子数目相等,则二者物质的量相等,H2SO4分子数目为0.2mol×6.02×1023mol-1=1.204×1023;
H3PO4与HCl含有相同分子数目,则HCl物质的量为0.2mol;
与H3PO4含有相同原子总数的NH3 的物质的量为$\frac{0.2mol×8}{4}$=0.4mol,
故答案为:0.6;1.204×1023;0.2;0.4.
点评 本题考查物质的量有关计算,侧重微粒数目计算,注意对化学式的理解,有利于基础知识的巩固.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑥ | B. | ⑤ | C. | ②⑤ | D. | ①③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大小烧杯间填满碎纸片 | B. | 大烧杯上用硬纸板作盖板 | ||
| C. | 使用环形玻璃搅拌棒 | D. | 分别使用两个量筒量取酸液和碱液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 摩尔质量g/mol-1 | 密度 | 1mol物质的体积 |
| Al | 26.98 | 2.70g•cm-3 | |
| Fe | 55.85 | 7.86g•cm-3 | |
| H2O | 18.02 | 0.998g•cm-3 | |
| C2H5OH | 46.07 | 0.789g•cm-3 | |
| H2 | 2.016 | 0.0899g•L-1 | |
| N2 | 28.02 | 1.25g•L-1 | |
| CO | 28.01 | 1.25g•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
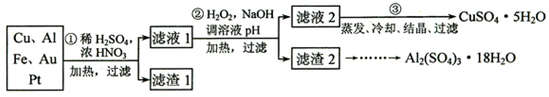
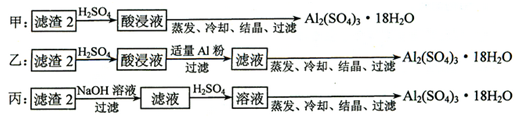
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com