
(14分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了普遍的重视。
(1)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:

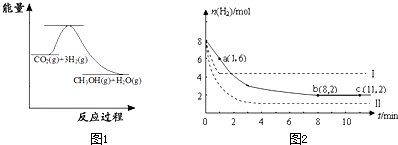
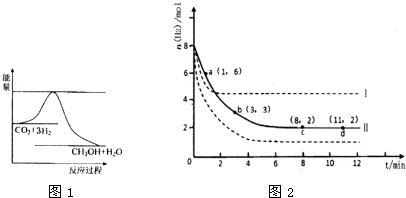
下图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
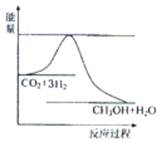
①该反应是 (填“吸热”或“放热”)反应。
②反应体系中加入催化剂对反应热是否有影响? (填“是”或“否”),原因是 。
(2)若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如图所示(实线)。
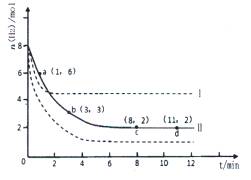
①该条件下反应的平衡常数K= 。请在答题卷图中绘出甲醇的物质的量随时间变化曲线。
②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 ,曲线Ⅱ对应的实验条件改变是 。
③下列措施中能使H2转化率增大的是 。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来 D.再充入3mol CO2和4mol H2
(3)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。已知:

写出CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式 。
(1)①放热 (1分) ②否 (1分)催化剂不能改变化学反应始态和终态的能量(2分) (2)①0.5 (2分)
②升高温度 (1分)增大压强 (1分)③CD(2分)
(3)CO2(g)+4H2(g)
 CH4(g)+2H2O (l) △H=-252.9kJ·mol-1 (2分)
CH4(g)+2H2O (l) △H=-252.9kJ·mol-1 (2分)
【解析】(1)根据图像可知,反应物的总能量高于生成物的能量,所以是放热反应。催化剂能改变活化能,但不能改变反应热。
(2)①平衡时氢气的物质的量是2mol,消耗氢气是6mo。所以根据反应式可知,消耗CO2是2mol,生成甲醇和水的物质的量都是2mol。所以平衡常数为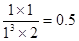 。
。
②曲线1到达平衡的时间少,说明反应速率快。但平衡时氢气的物质的量多,说明平衡向逆反应方向移动。因为反应是体积减小的、放热的可逆反应,所以改变的条件是升高温度。曲线Ⅱ到达平衡的时间少,说明反应速率快。但平衡时氢气的物质的量少,说明平衡向正反应方向移动。因为反应是体积减小的、放热的可逆反应,所以改变的条件是增大压强。
③升高温度平衡向逆反应方向移动,氢气转化率降低,B中体积不变,浓度不变,平衡不移动。C相当于降低生成物浓度,平衡向正反应方向移动,转化率增大。D相当于增大压强,平衡向正反应方向移动,转化率增大。答案选CD。
(3)考查盖斯定律的应用。根据反应式可知,将第二个×2减去第一式即得到CO2(g)+4H2(g) CH4(g)+2H2O (l),所以反应热是-285.8kJ·mol-1×4+890.3kJ·mol-1=△H=-252.9kJ·mol-1。


科目:高中化学 来源: 题型:
 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| 16 |
| 3 |
| 16 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| c(CH3OH)×c(H2O) |
| c(CO2)×c3(H2) |
| c(CH3OH)×c(H2O) |
| c(CO2)×c3(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com