
| A���٢ڢ� | B���٢ۢ� | C���ۢݢ� | D���ڢܢ� |


 ��ѧ��������������Ͼ���ѧ������ϵ�д�
��ѧ��������������Ͼ���ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��������Һ�е�c(Cl-)�������Һ�е�c(CH3COO-)��� |
| B��������NaOH��ȫ�к�ʱ��������Һ�����ĵ�NaOH�� |
| C���ֱ���ˮϡ����ͬ����ʱ��n(Cl-)��n(CH3COO-) |
| D�����Ƿֱ�������CaCO3��Ӧʱ���ų���CO2һ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ˮ�ĵ���̶�ʼ������ |
| B��c��NH4+��/c��NH3?H2O���������ټ�С |
| C��c��CH3COOH����c��CH3COO?��֮��ʼ�ձ��ֲ��� |
| D�������백ˮ�����Ϊ10mLʱ��c(NH4+)=c(CH3COO?) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ��� | ʵ������ | ʵ��Ŀ�� |
| A | �����£���pH��ֽ�ֱ�ⶨŨ��Ϊ0.1mol��L��1NaClO��Һ��0.1mol��L��1CH3COONa��Һ��pH | �Ƚ�HClO��CH3COOH������ǿ�� |
| B | ���з�̪��Na2CO3��Һ�м�������BaC12���壬��Һ��ɫ��dz | ֤��Na2CO3��Һ�д���ˮ��ƽ�� |
| C | ��10mL 0.2 mol/L NaOH��Һ�е���2��0.1 mol/L MgCl2��Һ��������ɫ�������ٵμ�2��0.1 mol/LFeCl3��Һ�������ɺ��ɫ���� | ֤������ͬ�¶��µ�Ksp�� Mg(OH)2 ��Fe(OH)3 |
| D | �ֱ�ⶨ�����µ����ʵ���Ũ�ȵ�Na2SO3��Na2CO3��Һ��pH�����߽ϴ� | ֤���ǽ�����S��C |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
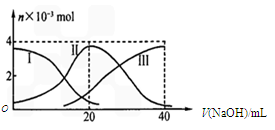
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A����Ũ�ȵ�NaClO��NaHCO3�����Һ�У�c��HClO��+c��ClO����= c��HCO ��+c��H2CO3�� ��+c��H2CO3�� |
| B��pH��4.5������֭��c��H+����pH=6.5�ķ���֭��c��H+����100�� |
| C��100 ml pH��3��HA��Һ��HB��Һ�ֱ���������п��Ӧ��HA��Һ�ų��������϶࣬˵��HA�����Ա�HB��ǿ |
| D��pH=5.5��CH3COOH��CH3COONa�����Һ�У�c��Na+��> c��CH3COO���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

 ��
�� ��
��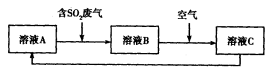
 ___pH
___pH ������
�������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����������ʵ���Ũ����ȵ�Na2A��NaHA��Һ�У�������������� |
| B���к͵����pH=11������������Һ������pH=3������Һ���������pH=3�������� |
| C��c(NH4+)��ȵ�(NH4)2SO4��Һ��(NH4)2CO3��Һ��NH4Cl��Һ��Ũ�ȹ�ϵ�� c[(NH4)2CO3]<c[(NH4)2SO4]<c(NH4Cl) |
| D����ʽ��NaHA��ˮ��Һ�ʼ��ԣ����ӵ����ʵ���Ũ�ȹ�ϵ��c��Na+��>c��HA����>c��OH����>c��H+��>c��A2���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ��� | �� | �� | �� | �� |
| ��Һ | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
| pH | 8.8 | 9.7 | 11.6 | 10.3 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com