
【题目】有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生。
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。
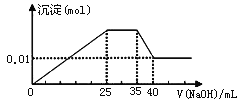
根据上述实验,以下推测不正确的是
A. 原溶液一定不存在H+、Cu2+、CO32-
B. 不能确定原溶液是否含有K+、NO3-
C. 实验所加的NaOH的浓度为2mol·L-1
D. 原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n( NH4+)=1:1:2
【答案】B
【解析】试题分析:溶液是无色透明的,所以不含有颜色的离子,故Cu2+水溶液是蓝色的,一定不存在;通过图象知,向溶液中加入过量的NaOH的过程中,开始滴加立刻有沉淀生成,说明不含有H+;当NaOH溶液过量时沉淀部分溶解,推断一定含有Al3+;K+不能和中学常见物质反应产生特殊现象进行判断,只能用焰色反应判断,则不能确定是否含K+;①第一份加足量AgNO3溶液后,有白色沉淀产生,推断含有CO32-、SO42-两种中的至少一种.因通过图象知含有Al3+;铝离子和碳酸根离子发生双水解,不能共存,所以推断一定不含有CO32-、则一定含有SO42-;②第二份加足里BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g,推断生成n(BaSO4)=3×10-2mol,根据元素守恒可知n(SO42-)= n(BaSO4)=3×10-2mol;③根据第三份逐滴滴加NaOH溶液产生沉淀与NaOH溶液的体积关系图,可知,一开始滴加NaOH就有沉淀生成,说明不含有H+,沉淀部分溶解,推断一定含有Al3+;图象中有一段平台,说明加入OH-时无沉淀生成,反应是NH4++OH-=NH3·H2O,有NH4+存在,最后溶液中有沉淀,说明溶液中含Mg2+,通过此实验无法判断是否含有K+。A.由上述分析可知,原溶液一定不存在H+、Cu2+、CO32-,A正确;B.原溶液确定含有Mg2+、Al3+、NH4+,由图可知,沉淀最大时是氢氧化镁、氢氧化铝沉淀,且n[Mg(OH)2]+n[Al(OH)3]=0.02mol,沉淀最小时,为氢氧化镁,故n[Mg(OH)2]=0.01mol,故n[Al Al(OH)3]=0.02mol-0.01mol=0.01mol,根据铝元素守恒可知n(Al3+)=n[Al(OH)3]=0.01mol,根据Al3++3OH-= Al(OH)33↓,需OH-0.03mol;根据镁元素守恒可知原溶液中n(Mg2+)=n[Mg(OH)2]=0.01mol,根据Mg2++2OH-=Mg(OH)2↓,需OH-0.02mol;生成沉淀最大量时需OH-0.05mol,由图可知消耗Na0H25mL,所以c(NaOH )===2mol/L;根据NH4++OH-=NH3·H2O,所以可得到NH4+的物质的量为0.01L×2mol/L=2×10-2mol,则n(Mg2+):n(Al3+):n(NH4+):n(SO42-)═0.01mol:0.01mol:2×10-2mol:3×10-2mol=1:1:2:3,由电荷守恒可知1×2+1×3+2×1>3×2,则应存在NO3-,B错误;C.由选项B的计算可知,实验所加的NaOH的浓度为2mol/L,C正确;D.由选项B的计算可知,原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n(NH4+)=1:1:2,D正确。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列对同系物归纳错误的是( )
A.同系物都具有相同的最简式B.同系物的结构相似
C.同系物一般符合同一通式D.同系物彼此在组成上相差一个或若干个某种原子团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是:
A. Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂
B. C1O2具有还原性,可用于自来水的杀菌消毒
C. SiO2硬度大,可用于制造光导纤维
D. 氢氟酸具有酸性,可用来蚀刻玻璃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积的AlCl3和NaOH两溶液混合,充分反应后,沉淀和溶液中所含铝元素的质量相等,则AlCl3和NaOH两溶液的物质的量浓度之比可能为
①2:3 ②2:7 ③1:3 ④1:4
A. ③④ B. ①③ C. ②④ D. ①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
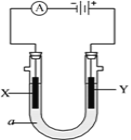
⑴若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴石蕊试液,则电解池中Y极上的电极反应式是________________。
在Y极附近放湿润的淀粉碘化钾试纸观察到的现象是_________________。
②X电极上发生的反应属于__________ 反应。
③电解后X极产生白色沉淀,则该沉淀最有可能是(填化学式)_______。
⑵如要用电解方法实现将铁片镀上一层金属银,电解液a选用硝酸银溶液,则
①X电极的材料是_________。
②Y电极反应式是___________________________________________。
③已知开始时铁片与银片的质量相同,当电路中有0. 4摩尔电子通过时,两极质量相差___________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 漂白粉、水玻璃、冰醋酸都是混合物
B. 金属氧化物一定是碱性氧化物
C. 根据丁达尔现象可以将分散系分为溶液、胶体和浊液
D. 氨气、水和硫酸钡分别属于非电解质、弱电解质和强电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL 1mol/LCa(HCO3)2溶液中投入Na,当沉淀最大量时,至少需要Na的质量是( )g
A. 2.3 B. 4.6 C. 1.15 D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型LiFePO4可充电锂离子动力电池以其独特的优势成为绿色能源的新宠。已知该电池放电时的电极反应如下:正极:FePO4+Li++e-=LiFePO4,负极:Li-e-=Li+。下列说法中正确的是
A. 充电时动力电池上标注“+”的电极应与外接电源的正极相连
B. 放电时电池反应为FePO4+Li++e-=LiFePO4
C. 放电时电池内部Li+向负极移动
D. 放电时,在正极上Li+得电子被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于硝酸的说法正确的是( )
A.硝酸与金属反应时,主要是+5价的氮得电子
B.浓HNO3与浓HCl按3∶1的体积比所得的混合物叫王水
C.硝酸电离出的H+离子,能被Zn、Fe等金属还原成H2
D.常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com