

| A. | 煤、石油中的硫元素燃烧时能生成SO2 | |
| B. | 动物尸体腐败过程产生的H2S气体会进入大气 | |
| C. | 循环过程中硫元素既发生氧化反应又发生还原反应 | |
| D. | 大气中的硫元素会全部转化成H2SO4随雨水降到土壤里 |
分析 A、硫元素燃烧后的产物都二氧化硫;
B、气体易扩散;
C、动物尸体腐败过程产生的H2S气体会进入大气,与煤、石油中的硫元素燃烧时能生成SO2,硫化氢与二氧化硫生成单质硫,发生氧化还原反应;
D、大气中的硫元素不是全部转化成H2SO4,有生成硫酸盐.
解答 解:A、硫元素燃烧后的产物都二氧化硫,所以煤、石油中的硫元素燃烧时能生成SO2,故A正确;
B、气体易扩散,所以动物尸体腐败过程产生的H2S气体会进入大气,故B正确;
C、动物尸体腐败过程产生的H2S气体会进入大气,与煤、石油中的硫元素燃烧时能生成SO2,硫化氢与二氧化硫生成单质硫,发生氧化还原反应,故C正确;
D、大气中的硫元素不是全部转化成H2SO4,有生成硫酸盐,而不是全部是硫酸,故D错误;
故选D.
点评 本题考查了大气循环中硫元素的转化,涉及氧化还原、密度等性质,难度不大,比较容易.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 同分异构体: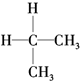 、 、 | B. | 烷烃:CH4、 、CH2═CH2 、CH2═CH2 | ||
| C. | 糖类:葡萄糖、蔗糖、纤维素 | D. | 有机高分子:塑料、橡胶、油脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | |
| C | D |
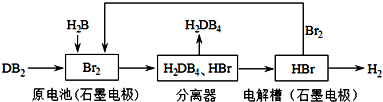
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
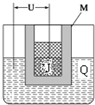 已知X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y2是空气主要成分之一.请回答:
已知X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y2是空气主要成分之一.请回答: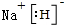
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
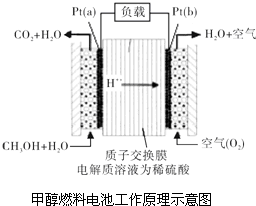 科学家预言,燃料电池将是21世纪获得电能的重要途径.近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过.其工作原理的示意图如图所示:
科学家预言,燃料电池将是21世纪获得电能的重要途径.近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过.其工作原理的示意图如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
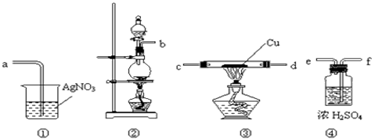
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使它转化为较稳定物质,便于保存和运输 | |
| B. | 增强漂白和消毒作用 | |
| C. | 使转化为较易溶于水的物质 | |
| D. | 增加氯的质量分数,有利于漂白、消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
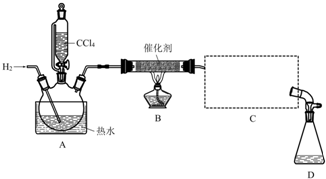
| 物质 | 相对分子质量 | 密度/(g•mL-1) | 沸点/℃ | 水中溶解性 |
| CHCl3 | 119.5 | 1.50 | 61.3 | 难溶 |
| CCl4 | 154 | 1.59 | 76.7 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,32g O2和O3的混合气体所含原子数为2NA | |
| B. | 100 mL 1 mol•L-1K2SO4溶液中含有的钾离子数为0.1NA | |
| C. | 10克氖气所含原子数约为6.02×1023 | |
| D. | 常温常压下,NA个H2分子的体积小于22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com