
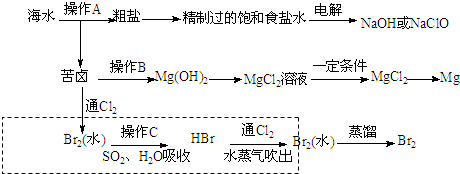
分析 海水晒盐过滤得到苦卤和粗盐,粗盐精制得到饱和食盐水,电解得到氢氧化钠和次氯酸钠,苦卤中加入石灰乳沉淀镁离子形成氢氧化镁沉淀,过滤得到氢氧化镁沉淀中加入盐酸溶解得到氯化镁溶液,蒸发浓缩,冷却结晶得到氯化镁晶体,在氯化氢气流中加热得到氯化镁,电解熔融氯化镁得到金属镁;苦卤中通入氯气氧化溴离子为单质溴,用二氧化硫水溶液吸收溴单质,得到HBr,再通入氯气氧化溴化氢得到溴单质,富集溴元素,用水蒸气吹出蒸馏得到液溴,
(1)在除杂的过程中每步加入的试剂必须是过量的,使离子除尽;过量的离子在下一步中必须出去,故先加入BaCl2,除去硫酸根,过量的钡离子,加入Na2CO3除去.根据提供的Ksp数据,在后面加入碳酸钠时,发生BaSO4(s)+CO32- (aq)=BaCO3(s)+SO42- (aq);
(2)根据工业制镁的原理从原料的成本以及性质来分析;
(3)氯气氧化溴离子得到单质溴;操作C是用二氧化硫吸收溴,生成溴化氢和硫酸;根据起初有溴最终也有溴,考虑物质的富集;根据流程图可知氯化钠、氯化镁的富集.
解答 解:(1)加入过量的Na2CO3和NaOH,可分别除去Ca2+、Mg2+,在除杂的过程中每步加入的试剂必须是过量的,使离子除尽;过量的离子在下一步中必须出去,故先加入BaCl2,除去硫酸根,过量的钡离子,加入Na2CO3除去.BaSO4和BaCO3的Ksp相差不大,当溶液中存在大量CO32-时,发生BaSO4(s)+CO32- (aq)=BaCO3(s)+SO42- (aq),BaSO4(s)会部分转化为BaCO3(s),
故答案为:BaCl2;BaSO4和BaCO3的Ksp相差不大,当溶液中存在大量CO32-时,BaSO4(s)会部分转化为BaCO3(s);
(2)工业制镁:把海边的贝壳制成生石灰:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,在海水中加入生石灰:CaO+H2O═Ca(OH)2,在引入的海水中加入石灰乳,发生反应:MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2,这样原料的成本低,且能将镁离子全部沉淀下来,所以最合适的是石灰乳,
故选:c;
(3)氯气氧化溴离子得到单质溴,离子方程式为:Cl2+2Br-=Br2+2Cl-,起初有溴最终也有溴,图中虚线框内流程的主要作用为溴的富集;根据流程图可判断海水蒸发结晶得到粗盐;苦卤→Mg(OH)2→MgCl2溶液等均是氯化钠,氯化镁的富集,
故答案为:Cl2+2Br-=Br2+2Cl-;富集Br2;海水蒸发结晶得到粗盐;苦卤→Mg(OH)2→MgCl2溶液.
点评 本题考查了海水资源的利用,序言提纯,溴、镁的制备过程分析,该题侧重对学生基础知识的巩固与训练,同时也注重对学生答题能力的培养和方法指导,有利于培养学生的逻辑思维能力和发散思维能力,属于中等难度的试题,试题综合性强.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发新能源,如太阳能、风能等,减少对化石能源的依赖 | |
| B. | 直径接近于2.5×10-6m的颗粒物(PM2.5)分散在空气中形成的混合物具有丁达尔效应 | |
| C. | 燃煤进行脱硫、脱硝处理,减少硫氧化物和氮氧化物的排放 | |
| D. | 通过吸收空气中CO2并利用廉价能源合成汽油可推广“绿色自由”计划 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol Fe在0.1mol Cl2中充分燃烧,转移的电子数为0.2NA | |
| B. | 1.2gNaHSO4固体中含有的阳离子数目为0.02NA | |
| C. | Na2O2与足量CO2反应生成2.24L O2,转移电子数为0.2NA | |
| D. | 4.6 g NO2和N2O4混合物中含有的原子总数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 检测次数 | 溶液中检测结果 |
| 第一次 | KCl、K2SO4、Na2CO3、NaCl |
| 第二次 | KCl、BaCl2、Na2SO4、K2CO3 |
| 第三次 | Na2SO4、KCl、K2CO3、NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com