
分析 (1)其中阳极附近内圈pH显示约为3,外圈约为5,是因为水中的氢氧根离子放电生成氧气,同时产生氢离子,浸润硫酸钠溶液的作用是增强溶液导电能力;
(2)阳极电极放电产生氯气,内圈为白色是次氯酸的漂白,外圈呈红色是盐酸的扩散所致;
(3)阳极碘离子发生氧化反应生成碘单质,碘单质与淀粉变蓝;
(4)迅速向外扩散形成一个蓝色的圈,是因为氯化钠中的氯离子放电生成氯气,氯气氧化碘离子;若将阴极、阳极由距离较远处使之彼此逐渐靠近,阳极所到之处,以电极与试纸接触处为中心呈现大片蓝色向外扩散,但阴极所到之处,蓝色即刻褪去,是因为碘单质与氢氧化钠发生歧化反应,反应的方程式为:I2+2NaOH=NaI+NaIO+H2O(写成3I2+6NaOH=5NaI+NaIO3+3H2O).
解答 解:(1)其中阳极附近内圈pH显示约为3,外圈约为5,是因为水中的氢氧根离子放电生成氧气,同时产生氢离子,导致氢离子的浓度大于氢氧根离子的浓度,浸润硫酸钠溶液的作用是增强溶液导电能力,故答案为:2H2O-4e-=O2↑+4H+;增强溶液导电能力;?
(2)阳极电极放电产生氯气,氯气与水反应生成的次氯酸和盐酸,内圈为白色是次氯酸的漂白,外圈呈红色是盐酸的扩散所致,故答案为:阳极氯离子放电产生氯气,氯气与水反应生成的次氯酸的漂白性使内圈呈白色,外圈呈红色 的原因是氯气与水反应生成的盐酸扩散所致;
(3)阳极碘离子发生氧化反应生成碘单质,电极反应式为:2I--2e-=I2,碘单质与淀粉变蓝,故答案为:出现蓝色; 2I--2e-=I2;
(4)迅速向外扩散形成一个蓝色的圈,是因为氯化钠中的氯离子放电生成氯气,氯气氧化碘离子;若将阴极、阳极由距离较远处使之彼此逐渐靠近,阳极所到之处,以电极与试纸接触处为中心呈现大片蓝色向外扩散,但阴极所到之处,蓝色即刻褪去,是因为碘单质与氢氧化钠发生歧化反应,反应的方程式为:I2+2NaOH=NaI+NaIO+H2O(写成3I2+6NaOH=5NaI+NaIO3+3H2O),故答案为:阳极产生的氯气迅速扩散的同时将碘化钾氧化为碘单质;I2+2NaOH=NaI+NaIO+H2O.
点评 本题考查原电池和电解池原理,明确试纸颜色变化与溶液酸碱性是关系是解本题关键,难点是电极反应式的书写,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 17gOH-中所含电子数为10NA | |
| B. | Na2O2固体中的阳离子和阴离子个数比是1:1 | |
| C. | 9g重水(${\;}_{1}^{2}$D2O)所含有的电子数为5NA | |
| D. | 在标准状况下,11.2L氖气含有NA个氖原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和SO2 | B. | Ca(OH)2和Cu(OH)2 | C. | H2SO4和H3PO4 | D. | ZnSO4和CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO4═Na++SO4-2 | B. | BaCl2═Ba2++Cl2- | ||
| C. | Al2(SO4)3═2Al3++3SO42- | D. | K2S═2K+S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuCl2溶液 | B. | KCl溶液 | C. | H2SO4溶液 | D. | K2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
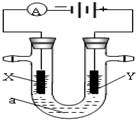 电解原理在化学工业中有广泛应用.下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液.请回答以下问题:
电解原理在化学工业中有广泛应用.下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
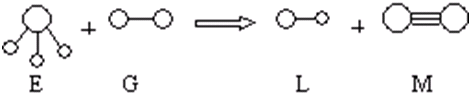
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
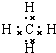 ,空间构型是正四面体,丙烷的结构简式为CH3CH2CH3,异丁烷的结构简式(CH3)2CH2CH3.
,空间构型是正四面体,丙烷的结构简式为CH3CH2CH3,异丁烷的结构简式(CH3)2CH2CH3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com