
| A. | 稀释溶液,$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$增大 | |
| B. | 加入NaOH固体,$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$减小 | |
| C. | 升高温度,平衡常数增大 | |
| D. | 通入CO2,溶液pH减小 |
分析 A.$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$为碳酸根离子的水解平衡常数;
B.加入氢氧化钠后,氢氧根离子浓度增大,平衡向着逆向移动;
C.盐的水解反应为吸热反应,升高温度平衡向着正向移动;
D.通入二氧化碳后,氢氧根离子浓度减小,平衡向着正向移动.
解答 解:A.碳酸根离子的水解平衡常数Kh=$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$,温度不变,则该比值不变,故A错误;
B.加入NaOH固体,溶液中氢氧根离子浓度增大,则水解平衡向着逆向移动,碳酸氢根离子浓度减小,碳酸根离子浓度增大,$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$的比值减小,故B正确;
C.升高温度,碳酸根离子的水解平衡向着逆向移动,则碳酸氢根离子、氢氧根离子浓度增大,碳酸根离子浓度减小,所以平衡常数Kh=$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$增大,故C正确;
D.二氧化碳与氢氧根离子反应,导致溶液中氢氧根离子浓度减小,溶液的pH减小,故D正确;
故选A.
点评 本题考查了盐的水解原理及其影响,题目难度中等,明确盐的水解原理为解答关键,注意盐的水解为吸热反应,试题培养了学生的分析能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:解答题
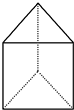 人们对苯及芳香烃的认识有一个不断深化的过程,回答下列问题.
人们对苯及芳香烃的认识有一个不断深化的过程,回答下列问题.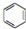 (Ⅱ)
(Ⅱ)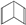
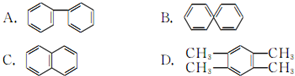
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
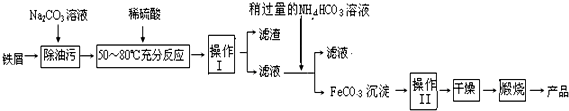
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3-[] | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5[] | 3×10-5 | 2×10-5 |
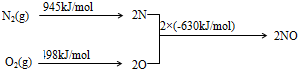
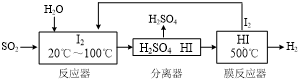
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有漂白性,能使滴有酚酞的NaOH溶液褪色 | |
| B. | Na2O2与水和二氧化碳反应都会生成氧气,可用作供氧剂 | |
| C. | MgO、Al2O3熔点高,可用于耐高温材料 | |
| D. | 常温下,铝与浓硝酸发生钝化,可用铝槽车贮运浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用丁达尔现象区分溶液与胶体 | |
| B. | 化学变化能够实现一种原子变为另一种原子 | |
| C. | O3是由3个氧原子构成的化合物 | |
| D. | CuSO4•5H2O是一种混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
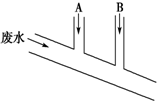 某化工厂排出的废水中含Cl2 0.014mol•L-1、H+ 0.001mol•L-1,废水排出的速度为10.0mL•s-1.为了除去此废水中的游离氯分子,并使废水变为中性,有人提出如下建议:在废水排出管A和B处分别注入一定流量的烧碱溶液(0.10mol•L-1)和Na2SO3溶液(0.10mol•L-1).下列说法错误的是( )
某化工厂排出的废水中含Cl2 0.014mol•L-1、H+ 0.001mol•L-1,废水排出的速度为10.0mL•s-1.为了除去此废水中的游离氯分子,并使废水变为中性,有人提出如下建议:在废水排出管A和B处分别注入一定流量的烧碱溶液(0.10mol•L-1)和Na2SO3溶液(0.10mol•L-1).下列说法错误的是( )| A. | 排出管A处发生的反应为SO32-+Cl2+H2O═SO42-+2Cl-+2H+ | |
| B. | 废水排出管B处发生的反应为H++OH-═H2O | |
| C. | A处溶液的流量为1.4 mL•s-1 | |
| D. | B处溶液的流量为2.8 mL•s-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com