
分析 (1)酸溶液中醋酸为弱酸,硫酸和盐酸为强酸,硫酸是二元酸,氢离子浓度越大,溶液PH越小;
(2)体积相同、物质的量浓度相同的CH3COOH溶液与NaOH溶液混合后,生成醋酸钠溶液,溶液中醋酸根离子水解溶液显碱性;
(3)体积相同、pH相同的盐酸和CH3COOH溶液醋酸存在电离平衡,醋酸溶液浓度大于盐酸,与NaOH溶液完全中和时,醋酸消耗氢氧化钠溶液多.
解答 解:(1)氢离子浓度越大,溶液PH越小,酸溶液中醋酸为弱酸,硫酸和盐酸为强酸,硫酸是二元酸,0.1mol/L的下列溶液中氢离子浓度大小A.CH3COOH<B.HCl<C.H2SO4,则溶液pH由大到小的排列顺序是:A>B>C,
故答案为:A>B>C;
(2)体积相同、物质的量浓度相同的CH3COOH溶液与NaOH溶液混合后,生成醋酸钠溶液,溶液中醋酸根离子水解溶液显碱性,溶液中各种离子浓度由大到小的顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故答案为:碱;c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(3)因醋酸为弱酸,存在电离平衡,CH3COOH?CH3COO-+H+,盐酸为强酸,则pH值相同的HCl溶液和CH3COOH溶液,醋酸的浓度大,所以体积相同,pH值相同的HCl溶液和CH3COOH溶液,与NaOH溶液中和时,体积相同、pH相同的盐酸和CH3COOH溶液与NaOH溶液完全中和时,消耗NaOH的物质的量较多的是
故答案为:醋酸;因醋酸为弱酸,存在电离平衡,CH3COOH?CH3COO-+H+,盐酸为强酸,则pH值相同的HCl溶液和CH3COOH溶液,醋酸的浓度大.
点评 本题考查了电解质溶液中离子浓度大小比较、溶液酸碱性判断、弱电解质电离平衡的影响因素等知识点,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
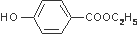 ,其生产过程如图所示(反应条件未全部注明):
,其生产过程如图所示(反应条件未全部注明):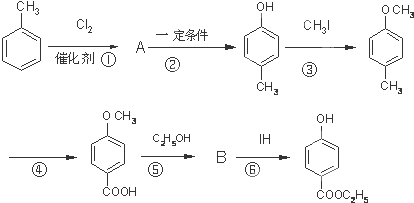
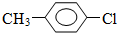 .
. +CH3I→
+CH3I→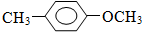 +HI
+HI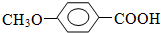 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$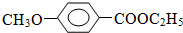 C2H5OH+H2O
C2H5OH+H2O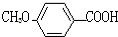 的同分异构体有多种,其中既含有酚羟基,又含有醇羟基和醛基的同分异构体共有13种,写出其中一种结构简式
的同分异构体有多种,其中既含有酚羟基,又含有醇羟基和醛基的同分异构体共有13种,写出其中一种结构简式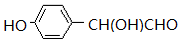 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Mg(OH)2 | CaCO3 | MgCO3 | Ca(OH)2 | CaSO4 | MgSO4 |
| $\frac{溶解度}{g/100g{H}_{2}O}$ | 9.0×10-4 | 1.5×10-3 | 1.0×10-2 | 1.7×10-1 | 2.1×10-1 | 26.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知:在常温下,浓度均为0.1mol•L-1的下列六种溶液的pH:
(1)已知:在常温下,浓度均为0.1mol•L-1的下列六种溶液的pH:| 溶质 | CH3CO ONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,正确的是( )
,正确的是( )| A. | 3,3-二甲基-2-乙基戊烷 | B. | 3,3,4-三甲基己烷 | ||
| C. | 2-乙基-3,3-二甲基戊烷 | D. | 3,4,4-三甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮、磷、硫、氯、砷等是农药中的重要组成元素.回答下列问题:
氮、磷、硫、氯、砷等是农药中的重要组成元素.回答下列问题: 是一种天然植物杀虫剂,其中N原子的杂化方式为sp3
是一种天然植物杀虫剂,其中N原子的杂化方式为sp3查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和NaOH完全反应的中和热为-114.6kJ/mol | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则表示CO燃烧热的热化学方程式为2CO(g)+O2(g)═2CO2(g);△H=-283.0kJ/mol | |
| C. | 一个化学反应的热效应,只与反应的始态与终态有关,与反应的过程无关 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com