
分析 ①该溶液呈无色判断MnO4-、Cu2+离子不存在;
②经测定溶液的pH=12,说明溶液显碱性,Mg2+、HCO3-离子一定不存在;
③取少量溶液,加入100mL 2mol•L-1稀盐酸进行酸化,有白色沉淀生成,盐酸是过量的,说明生成的白色沉淀为硅酸沉淀,证明一定含有SiO32-,还得到一种无色无味的气体,该气体使澄清石灰水(足量)变浑浊,证明一定含CO32-离子,对酸化后的溶液过滤,得到滤液甲,将滤液甲分成两等份,一份中逐滴加入氨水,刚开始加入氨水时,没有沉淀产生,是中和过量的盐酸,反应后和溶液中铝离子反应生成氢氧化铝白色沉淀,最终有白色胶状沉淀为氢氧化铝,说明原溶液中一定含AlO2-,另一份中加入足量的Ba(NO3)2溶液,有白色沉淀生成,说明一定含硫酸根离子,过滤得到滤液乙,往滤液乙中加入足量的AgNO3溶液,过滤、洗涤、干燥得固体26.5g,说计算氯化银物质的量和原加入盐酸中氯离子物质的量判断是否含氯离子,据此分析回答.
解答 解:①该溶液呈无色判断MnO4-、Cu2+离子不存在;
②经测定溶液的pH=12,说明溶液显碱性,Mg2+、HCO3-离子一定不存在;
③取少量溶液,加入100mL 2mol•L-1稀盐酸进行酸化,有白色沉淀生成,盐酸是过量的,说明生成的白色沉淀为硅酸沉淀,证明一定含有SiO32-,还得到一种无色无味的气体,该气体使澄清石灰水(足量)变浑浊,证明一定含CO32-离子,对酸化后的溶液过滤,得到滤液甲,将滤液甲分成两等份,一份中逐滴加入氨水,刚开始加入氨水时,没有沉淀产生,是中和过量的盐酸,反应后和溶液中铝离子反应生成氢氧化铝白色沉淀,最终有白色胶状沉淀为氢氧化铝,说明原溶液中一定含AlO2-,另一份中加入足量的Ba(NO3)2溶液,有白色沉淀生成,说明一定含硫酸根离子,过滤得到滤液乙,往滤液乙中加入足量的AgNO3溶液,过滤、洗涤、干燥得固体26.5g,说明含氯离子,
(1)由①②③可判断:原溶液中一定不存在的离子是:MnO4-、Cu2+、Mg2+、HCO3-;一定存在的离子是CO32-、SiO32-,
故答案为:MnO4-、Cu2+、Mg2+、HCO3-;CO32-、SiO32-;
(2)将滤液甲分成两等份,一份中逐滴加入氨水,刚开始加入氨水时,没有沉淀产生,最终有白色胶状沉淀,说明原溶液中一定有AlO2-;刚开始加入氨水时,没有沉淀产生,是中和过量的盐酸,即NH3•H2O+H+=NH4++H2O; 另一份中加入足量的Ba(NO3)2溶液,有白色沉淀生成,说明原溶液中一定有SO42-,
故答案为:AlO2-;NH3•H2O+H+=NH4++H2O; SO42-;
(3)往滤液乙中加入足量的AgNO3溶液,过滤、洗涤、干燥得固体26.5g,说明生成了氯化银沉淀,n(AgCl)=$\frac{26.5g}{143.5g/mol}$=0.18mol,则甲乙两份中含氯离子物质的量=0.18mol×2=0.36mol,加入100mL 2mol•L-1稀盐酸进行酸化,n(HCl)=0.1L×2mol•L-1=0.2mol,说明原溶液中一定含氯离子,
故答案为:是.
点评 本题考查了离子检验、离子性质、离子反应现象的判断、离子共存的理解应用,掌握基础是解题关键,题目难度中等,侧重于考查学生的分析能力和对基础知识的综合应用能力.


科目:高中化学 来源: 题型:选择题
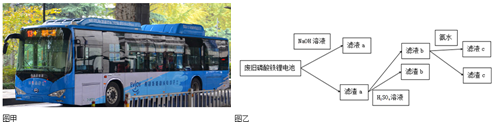
| A. | 向滤液a中加入适量溶液,可以得到白色沉淀 | |
| B. | 滤液b中加入氨水的目的是使沉淀,滤渣c为红褐色 | |
| C. | 要将Li从溶液中析出,可在滤液c中加入足量溶液,加热浓缩,冷却结晶 | |
| D. | 图中的氨水可以用适量NaOH溶液代替. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

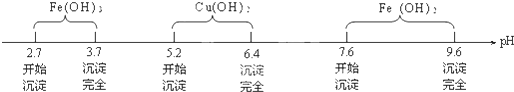

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:
东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molH2约含有6.02×1023个微粒 | |
| B. | 1mol任何物质都约含有6.02×1023个分子 | |
| C. | 32gO2和O3的混合气体中约含1.204×1024个氧原子 | |
| D. | 1mol氖气中约含有1.204×1024个氖原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
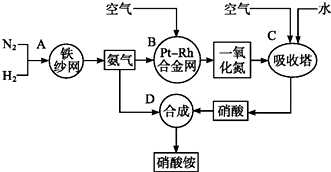
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


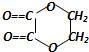 +2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.
+2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com