

分析 铁粉的作用由步骤①的前后以及最后所得产物中的FeSO4•7H2O分析,不难得出是为了除去混合溶液中的Fe3+;步骤②冷却的目的由操作过滤和得到的物质是FeSO4•7H2O可得,是为降低FeSO4•7H2O的溶解度;上述过程中,可以利用的副产物也可从反应产物入手分析为FeSO4•7H2O、CO、MgCl2;Mg是活泼金属,能与空气中多种物质反应,因此可得出Ar气作用为保护气,防止Mg和空气中物质反应;图示水浸过程生成H2TiO3同时生成的H2SO4溶液(TiOSO4+2H2O=H2TiO3+H2SO4),应加入碱性物质处理,依盖斯定律,根据已知①,②可推算出2C(s)+O2(g)=2CO(g)的△H=2×(-393.5)+566=-221 kJ•mol-1,由此结合③可推算出△H=-221+141=-80 kJ•mol-1,据此答题.
解答 解:(1)Ti位于元素周期表中第四周期ⅣB族,
故答案为:四;ⅣB;
(2)铁粉的作用是为了除去混合溶液中的Fe3+;步骤②冷却的目的由操作过滤和得到的物质是FeSO4•7H2O可得,是为降低FeSO4•7H2O的溶解度,
故答案为:将Fe3+还原为Fe2+;析出(或分离、或得到)FeSO4•7H2O;
(3)得到的副产物为FeSO4•7H2O,图示水浸过程生成H2TiO3同时生成的H2SO4溶液(TiOSO4+2H2O=H2TiO3+H2SO4),应加入碱性物质处理,可以是石灰(或碳酸钙、废碱),
故答案为:FeSO4•7H2O; 石灰(或碳酸钙、废碱);
(4)依盖斯定律,将③+①×2-②可得:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g),
△H=(+141kJ•mol-1)+2×(-393.5kJ•mol-1)-(-566kJ•mol-1)=-80 kJ•mol-1,Mg是活泼金属,能与空气中多种物质反应,因此可得出Ar气作用为保护气,防止Mg和空气中物质反应,
故答案为:-80 kJ•mol-1; 防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用.
点评 本题考查学生对工艺流程理解、阅读题目获取信息能力、氧化还原反应及方程式的书写等,难度中等,理解工艺流程是关键,需要学生具有阅读题目获取信息能力和灵活运用基础知识分析问题、解决问题能力.


科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 CH3COOH溶液的pH>1:CH3COOH?CH3COO-+H+ | |
| B. | “NO2球”浸泡在冷水中,颜色变浅:2NO2(g)???N2O4(g)△H<0 (红棕色) (无色) | |
| C. | 铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO${\;}_{3}^{-}$═3Fe3++2NO↑+4H2O | |
| D. | 向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO${\;}_{3}^{2-}$+H2O?HCO${\;}_{3}^{-}$+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
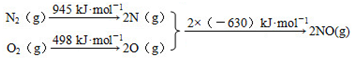

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
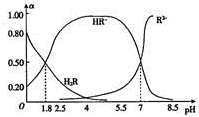 室温时,0.1mol.L-1二元弱酸HzR溶液中H2R、HR-、R2-三种微粒所占物质的量分数(a)随pH的变化趋势如图所示.下列说法不正确的是( )
室温时,0.1mol.L-1二元弱酸HzR溶液中H2R、HR-、R2-三种微粒所占物质的量分数(a)随pH的变化趋势如图所示.下列说法不正确的是( )| A. | H2R的一级电离平衡常数Kal≈0.25 | |
| B. | pH=2.5的H2R溶液中:c(HR-)+2c(R2-)+c(OH-)=l0-2.5 | |
| C. | pH=5.5的该溶液中:c(HR一)>c(R2一)>c(H+)>c(OH一) | |
| D. | 向pH=7的该溶液中滴加少量稀硫酸,a(HR-)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L乙烯所含共用电子对数为5NA | |
| B. | 72g Ca02所含离子总数为3NA | |
| C. | 常温下,将1mol Cl2通入到过量的NaOH溶液中,电子转移数目为NA | |
| D. | 1L0.1mol/L Na2C03溶液中,C032-数目为0.lNA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 实验室里要配制465mL 0.2mol/L的硫酸钠溶液.
实验室里要配制465mL 0.2mol/L的硫酸钠溶液.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com