
 )是一种化学活性很高的烃,存在于煤焦油中.
)是一种化学活性很高的烃,存在于煤焦油中. $\stackrel{室温}{→}$
$\stackrel{室温}{→}$ ,反应类型为加成;该反应的产物除
,反应类型为加成;该反应的产物除 外,还有与双环戊二烯为同分异构体的其他副产物,写出其中一种的结构简式
外,还有与双环戊二烯为同分异构体的其他副产物,写出其中一种的结构简式 ;
; )是双环戊二烯的一种同分异构体,它的一氯代物有4种.
)是双环戊二烯的一种同分异构体,它的一氯代物有4种. 分析 (1)该分子中含有10个碳原子、12个H原子;
(2)该分子的不饱和度=$\frac{10×2+2-12}{2}$=5,碳碳双键的不饱和度是1、碳碳三键的不饱和度是2、苯环的不饱和度是4;
(3)该反应是加成反应,另一种反应可能是相邻碳原子间的碳碳双键断裂发生的反应;
(4)该分子中氢原子种类是4,有几种氢原子,其一氯代物就有几种.
解答 解:(1)该分子中含有10个碳原子、12个H原子,分子式为C10H12,故答案为:C10H12;
(2)该分子的不饱和度=$\frac{10×2+2-12}{2}$=5,碳碳双键的不饱和度是1、碳碳三键的不饱和度是2、苯环的不饱和度是4,所以其同分异构体中可能含有碳碳双键、碳碳三键或苯环,故选abc;
(3)该反应是加成反应,另一种反应可能是相邻碳原子间的碳碳双键断裂发生的反应,结构简式为 ,故答案为:加成;
,故答案为:加成; ;
;
(4)该分子中氢原子种类是4,有几种氢原子,其一氯代物就有几种,所以其一氯代物有4种,故答案为:4.
点评 本题考查有机物结构和性质,为高频考点,侧重考查同分异构体、物质结构、反应类型判断等知识点,难点是同分异构体种类判断,注意不饱和度的计算方法及运用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 E、G、M、Q、T是五种原子序数依次增大的前四周期元素,E、G、M是位于P区的同一周期的元素,M的价层电子排布为Nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素,E、G、M是位于P区的同一周期的元素,M的价层电子排布为Nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题: .E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.
.E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 弱碱的浓度大于强酸的浓度 | |
| B. | 原氨水中有1%的含氮微粒为NH4+ | |
| C. | 反应后的溶液呈酸性 | |
| D. | 混合溶液中c(NH4+)+c(NH3•H2O)+c(NH3)=5×10-4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 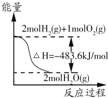 表示2 mol H2(g)所具有的能量一定比2 mol气态水所具有的能量多483.6 kJ | |
| B. | 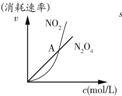 表示恒温恒容条件下发生的可逆反应2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 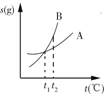 表示A、B两物质的溶解度随温度变化情况,将t1℃时的A、B饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| D. | 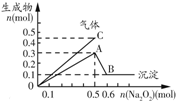 表示向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量的关系,则此溶液中n(Mg2+)、n(NH4+)、n(Al3+)的比为1:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
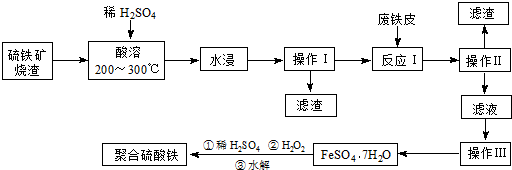
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
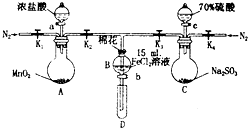 为验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).
为验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).| 过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com