
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
分析 (1)由表中数据可知,随温度升高平衡常数减小,说明升高温度平衡逆向移动,则正反应为放热反应;
某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则:
CO(g)+2H2(g)═CH3OH(g)
起始浓度(mol):1 3 0
变化浓度(mol):0.8 1.6 0.8
平衡浓度(mol):0.2 1.4 0.8
转化率=$\frac{浓度变化量}{起始浓度}$×100%,根据K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$计算平衡常数,进而判断温度;
(2)利用盖斯定律构造目标热化学方程式并求焓变;
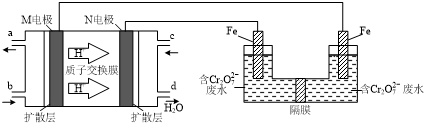
(3)①氢离子由质子交换膜由M电极区移向N电极区,则M为负极、N为正极,负极上发生氧化反应,甲醇失去电子,生成二氧化碳与氢离子,正极发生还原反应,氧气获得电子,与通过质子交换膜的氢离子结合为水;
②电解池溶液里Cr2O72-转化为Cr3+,化合价降低共6价,左侧Fe电极为阳极,Fe失去电子生成Fe2+,酸性条件Fe2+将Cr2O72-还原为Cr3+,自身被氧化为Fe3+,化合价升高共1价,化合价升降最小公倍数为6,则Cr2O72-的系数为1,Fe2+的系数为6,再结合电荷守恒、原子守恒配平方程式;
(4)Ksp=c(Cr3+)×c3(OH-)=6.4×10?31计算c(OH-),根据Kw=c(H+)×(OH-)计算溶液中c(H+),再根据pH=-lgc(H+)计算.
解答 解:(1)由表中数据可知,随温度升高平衡常数减小,说明升高温度平衡逆向移动,则正反应为放热反应,故△H<0,某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则:
CO(g)+2H2(g)═CH3OH(g)
起始浓度(mol):1 3 0
变化浓度(mol):0.8 1.6 0.8
平衡浓度(mol):0.2 1.4 0.8
CO转化率=$\frac{0.8mol}{1mol}$×100%=80%,平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{0.8}{0.2×1.{4}^{2}}$=2.041,故温度为250℃,
故答案为:放;80%;250℃;
(2)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1 kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2 kJ/mol
③H2O(g)=H2O(l)△H3 kJ/mol
根据盖斯定律$\frac{1}{2}$(①-②+4③)可得:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=(△H1-△H2+4△H3)/2kJ/mol,
故答案为:(△H1-△H2+4△H3)/2;
(3)①氢离子由质子交换膜由M电极区移向N电极区,则M为负极、N为正极,负极上发生氧化反应,甲醇失去电子,生成二氧化碳与氢离子,负极电极反应式为:CH3OH-6e-+H2O=6H++CO2↑,正极发生还原反应,氧气获得电子,与通过质子交换膜的氢离子结合为水,正极电极反应式为:O2+4e?+4H+=2H2O,
故答案为:O2+4e?+4H+=2H2O;
②电解池溶液里Cr2O72-转化为Cr3+,化合价降低共6价,左侧Fe电极为阳极,Fe失去电子生成Fe2+,酸性条件Fe2+将Cr2O72-还原为Cr3+,自身被氧化为Fe3+,化合价升高共1价,化合价升降最小公倍数为6,则Cr2O72-的系数为1,Fe2+的系数为6,反应离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
故答案为:1;6;14H+;2;6;7H2O;
(4)Ksp=c(Cr3+)×c3(OH-)=6.4×10?31,c(Cr3+)=1×10?5mol•L-1 时,溶液中c(OH-)=4×10?9mol•L-1,则c(H+)=$\frac{1{0}^{-14}}{4×1{0}^{-9}}$mol/L=2.5×10?6mol•L-1,则pH=-lg2.5×10?6=5.6,
故答案为:5.6.
点评 本题考查反应热计算、电解原理、氧化还原反应配平、溶度积有关计算等,(3)注意根据质子移动方向判断电极,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 玻璃容器可长期盛放各种酸 | |
| B. | 水中加入明矾、硫酸铁溶液可以起净水作用 | |
| C. | Al2O3可制造耐高温的实验仪器 | |
| D. | Na2S可除去污水中有毒的Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入铝粉能产生H2的溶液:Fe2+、NH4+、SO42-、NO3- | |
| B. | 室温下水电离出c(H+)=1×10-13 mol/L的溶液:HCO3-、K+、SO42-、Cl- | |
| C. | 使酚酞变红色的溶液:Na+、K+、AlO2-、CO32- | |
| D. | 含大量Fe3+的溶液:NH4+、Na+、SCN-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘升华 | B. | 盐酸和氢氧化钠溶液混合 | ||
| C. | 氯化氢溶于水 | D. | 氯化氢与氨气反应生成氯化铵固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6﹕1 | B. | 9﹕1 | C. | 1﹕5.6 | D. | 1﹕9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有吸附性 | B. | 溶解度与CuS、PbS、Cd相同 | ||
| C. | 溶解度小于CuS,PbS、Cd | D. | 溶解度大于CuS,PbS,CdS |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅可用作半导体材料 | |
| B. | 甲醛可用作食品防腐剂 | |
| C. | 氧化铝熔点高,常用于制造耐火材料 | |
| D. | 高压钠灯发出黄光,透雾能力强,常用于道路和广场照明 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 华为自主研发的“麒麟”芯片与光导纤维是同种材料 | |
| B. | 研发煤炭的洁净、高效利用技术,保护生态环境 | |
| C. | 聚氯乙烯可作为包装材料,不会造成环境污染 | |
| D. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com