
常温下,在27.5g水中溶解12.5g CuSO4•5H2O,恰好达到饱和,该溶液密度为1.21g/cm3.求:
(1)该溶液中阴阳离子的总物质的量;
(2)该溶液中CuSO4的物质的量浓度;
(3)取出20.0mL该溶液,配成浓度为1.00mol/L的稀溶液,则稀释后溶液的体积是多少毫升?
(计算结果保留3位有效数字)
考点: 物质的量浓度的相关计算.
专题: 物质的量浓度和溶解度专题.
分析: (1)根据n=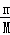 计算硫酸铜晶体的物质的量,分别计算Cu2+和SO42﹣离子的物质的量,二者之和为阴阳离子的总物质的量;
计算硫酸铜晶体的物质的量,分别计算Cu2+和SO42﹣离子的物质的量,二者之和为阴阳离子的总物质的量;
(2)计算溶液的质量,根据V=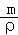 计算溶液体积,再根据c=
计算溶液体积,再根据c=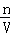 计算溶液中CuSO4的物质的量浓度;
计算溶液中CuSO4的物质的量浓度;
(3)根据稀释定律,溶液稀释前后溶质的物质的量不变,据此计算体积.
解答: 解:(1)12.5g CuSO4•5H2O的物质的量为: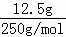 =0.05mol,电离产生的Cu2+和SO42﹣均为0.050mol,故阴阳离子的总物质的量为0.050mol+0.050mol=0.1mol,
=0.05mol,电离产生的Cu2+和SO42﹣均为0.050mol,故阴阳离子的总物质的量为0.050mol+0.050mol=0.1mol,
答:阴阳离子的总物质的量为0.1mol;
(2)溶液的体积为: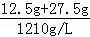 =0.0331L,故CuSO4的物质的量浓度为:
=0.0331L,故CuSO4的物质的量浓度为: =1.51mol/L,
=1.51mol/L,
答:CuSO4的物质的量浓度为1.51mol/L;
(3)取出溶液中含溶质硫酸铜的物质的量为:1.51mol/L×0.02L=0.0302mol,故稀释后溶液的体积为: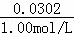 =0.0302L=30.2mL,
=0.0302L=30.2mL,
答:稀释后溶液的体积是30.2mL.
点评: 本题题考查物质的量浓度的有关计算,题目难度不大,注意对物质的量浓度的理解与灵活运用.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
中学常见物质A、B、C、D、E、X,存在如图转化关系(部分生成物和反应条件略去).下列推断不正确的是( )
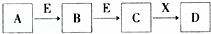
A. 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
B. 若D是一种强碱,则A、B、C均可与X反应生成D
C. 若D为NaCl,且A可与C反应生成B,则E可能是CO2
D. 若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是( )
A. 16g B. 32g C. 64g/mol D. 32g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
实验中的下列操作正确的是( )
A. 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中
B. Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道
C. 用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干
D. 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
A原子的结构示意图为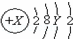 .则X、Y及该原子3p能级上的电子数分别为( )
.则X、Y及该原子3p能级上的电子数分别为( )
|
| A. | 18、6、4 | B. | 20、8、6 |
|
| C. | 18、8、6 | D. | 15~20、3~8、1~6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
第四周期元素的单质及化合物在工农业生产中应用广泛.
(1)第四周期元素中,基态原子的最外层只有1个电子的元素共有 种.元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.该元素的基态原子价电子排布为 .
(2)铂丝蘸取氯化钙在酒精灯上灼烧,火焰呈现砖红色,显色原因是 (填序号).
A.氯化钙受热挥发 B.氯化钙受热分解
C.钙离子中电子跃迁 D.氯离子中电子跃迁
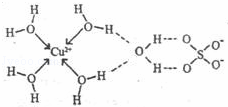
(3)无水硫酸铜呈白色,吸水后形成胆矾,呈蓝色.科学家通过X射线测定出胆矾的结构,其结构可用如图表示.
①胆矾晶体中除共价键、配位键及微弱的范德华力外,还存在的两种作用力是 和 .
②胆矾晶体CuSO4•5H2O可以写出[Cu(H2O)4]SO4•H2O,其中配位原子是 ,配位数是 .
③铜离子形成胆矾中配位离子的离子方程式为 .
④CO、NH3等也能与Cu+形成配合物.[Cu(NH3)n]+溶液可用于吸收合成氨原料气中的CO,加热吸收CO后的溶液又将放出CO.加热分解放出CO的过程中,必须克服微粒间的哪类作用力? .
⑤过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n= .
(4)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据如右表.据表判断Mn2+和Fe2+再失去﹣个电子的难易,并从原子结构的角度简述其原因 .
| 元素 | Mn | Fe |
|
| 电离能kJ•mol﹣1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作及装置合理并能达到实验目的是( )
|
| A. |
制取并收集氨气 |
|
| B. | . 收集并测定氧气的体积 |
|
| C. | . 制乙酸乙酯 |
|
| D. | . 用苯分离出碘水中的碘单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com