
 氮元素可形成卤化物、叠氮化物及络合物等.
氮元素可形成卤化物、叠氮化物及络合物等.分析 (1)NF3的沸点-129℃,符合分子晶体的性质;在铜催化作用下F2和过量NH3反应得到NF3,还生成NH4F;
(2)①原子总数相等、价电子总数也相等的微粒互为等电子体,等电子体的结构相似;
②钴原子核外电子数为27,根据能量最低原理书写基态时的价电子排布式;
[Co(N3)(NH3)5]SO4中配体为N3-、NH3;
CN-中C原子价层电子对数=1+$\frac{4+1-3}{2}$=2,杂化轨道数目为2;
(3)根据相似相溶原理,极性分子易溶于极性溶剂;
(4)A.离子半径越小,晶格能越大;
B.同主族自上而下第一电离能减小,P元素原子3p轨道为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的;
C.钠晶胞结构为体心立方密堆积,根据均摊法计算晶胞中分摊钠原子数目;
D.氮气性质稳定是由于氮气分子中含有氮氮三键.
解答 解:(1)NF3的沸点-129℃,沸点很低,属于分子晶体.在铜催化作用下F2和过量NH3反应得到NF3,还生成NH4F,反应方程式为:3F2+4NH3$\frac{\underline{\;Cu\;}}{\;}$NF3+3NH4F,
故答案为:分子;3F2+4NH3$\frac{\underline{\;Cu\;}}{\;}$NF3+3NH4F;
(2)①与N3-互为等电子体的微粒含有3个原子、16个价电子,与其等电子体的分子有N2O或CO2或CS2或BeCl2等,其等电子体的离子有 SCN-等;
N3-与CO2是等电子体,具有相同的价电子数,它们具有相似的化学结构,二氧化碳是直线型分子,所以N3-的空间构型是直线形,
故答案为:CO2;SCN-;直线;
②钴原子核外电子数为27,其基态原子核外电子排布式为1s22s22p63s23p63d74s2,价电子排布式为3d74s2,
[Co(N3)(NH3)5]SO4中配体为N3-、NH3,钴的配位数为6,
CN-中C原子价层电子对数=1+$\frac{4+1-3}{2}$=2,杂化轨道数目为2,C原子采取sp杂化;
故答案为:3d74s2;6;sp;
(3)极性分子易溶于极性溶剂中,水为极性溶剂,Pt(NH3)2Cl2的一种分子易溶于水,说明为极性分子;
故答案为:极性;
(4)A.离子电荷相同,钠离子半径小于钾离子半径,故NaN3的晶格能大于KN3的晶格能,故A错误;
B.同主族自上而下第一电离能减小,P元素原子3p轨道为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,故第一电离能N>P>S,故B正确;
C.钠晶胞结构为体心立方密堆积,晶胞中原子数为1+8×$\frac{1}{8}$=2,故C正确;
D.氮气分子中含有氮氮三键,键能较大,所以性质稳定,故D错误.
故选:BC.
点评 本题是对物质结构与性质的考查,涉及晶体类型与性质、核外电子排布、等电子体、配合物、杂化方式与空间构型、晶胞计算、电离能等,需要学生具备扎实的基础,注意同周期主族元素第一电离能异常情况.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
 某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.288g | B. | 0.366g | C. | 0.384g | D. | 0.396g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 400 | 500 | 600 |
| SO2转化率/% | 99.2 | 93.5 | 73.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
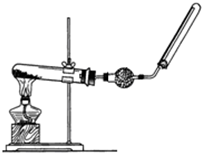 实验室中若用如图所示的装置制取并收集干燥的氨气.
实验室中若用如图所示的装置制取并收集干燥的氨气.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| B. | 第三周期元素的离子半径从左到右逐渐减小 | |
| C. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 | |
| D. | ⅣA族元素的氢化物中,稳定性最好的是CH4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com