
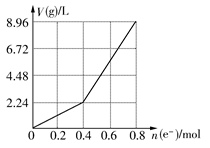
| A.电解前CuSO4溶液的物质的量浓度为2 mol/L |
| B.电解后所得溶液中c(H+)=2 mol/L |
| C.当n(e-)=0.6 mol时,V(H2):V(O2)=2:3 |
| D.向电解后的溶液中加入16 g CuO,则溶液可恢复为电解前的浓度 |
科目:高中化学 来源:不详 题型:单选题
 Al2O3 + 3H2↑,电解过程中,以下判断正确的是( )
Al2O3 + 3H2↑,电解过程中,以下判断正确的是( )| | 原电池 | 电解池 |
| A | H+移向Pb电极 | H+移向Pb电极 |
| B | 每消耗3molPb | 生成2molAl2O3 |
| C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
| D | 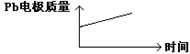 | 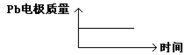 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
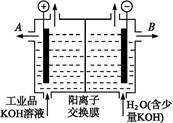
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaCl | B.Na2CO3 | C.CuSO4 | D.K2S |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
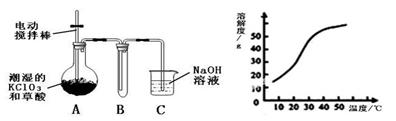
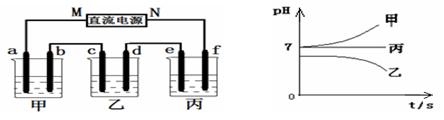
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
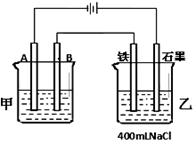
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X为C3H7COOH |
| B.电解的阳极反应式为C21H41COOH+X-2e-+2H2O=C23H46+CO32—+6H+ |
| C.电解过程中阴极区pH增大,Na+向阴极移动 |
| D.阴极的还原产物为H2和OH- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42-、OH- |
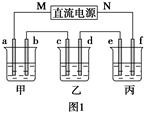
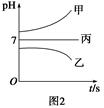
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
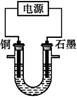
| A.铜电极连接电源正极 |
| B.黑色粉末X是铁粉 |
C.铜的相对原子质量的计算式是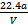 |
D.石墨电极上发生的反应是4OH--4e- O2↑+2H2O O2↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com