
”¾ĢāÄæ”æäå¼°Ęä»ÆŗĻĪļ¹ć·ŗÓĆÓŚŅ½Ņ©”¢ĖÜĮĻ×čČ¼¼ĮµČ£¬æąĀ±ĢįäåµÄ¹¤ŅµĮ÷³ĢČēĻĀ£ŗ
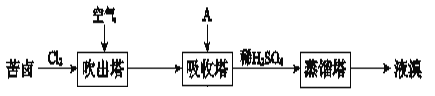
(1)Cl2ŗĶæąĀ±ÖŠµÄBr©·“Ӧɜ³ÉBr2µÄĄė×Ó·½³ĢŹ½ŹĒ_____”£
(2)½įŗĻŌŖĖŲÖÜĘŚĀɽāŹĶClµÄ·Ē½šŹōŠŌĒæÓŚBrµÄŌŅņ£ŗ_____”£
(3)ĪüŹÕĖžÖŠ£¬AĪüŹÕĮĖBr2ŗóµÄČÜŅŗÖŠŗ¬ÓŠBr©ŗĶBrO3©£¬ŌņAŹĒ_____£ØĢīŠņŗÅ£©”£
a£®NaClČÜŅŗ b£®Na2CO3ČÜŅŗ c£®SO2ĘųĢå
(4)“ÓĪüŹÕĖž³öĄ“µÄČÜŅŗÖŠ¼ÓČėĻ”H2SO4µĆµ½Br2µÄĄė×Ó·½³ĢŹ½ŹĒ_____”£
”¾“š°ø”æCl2+2Br©ØTBr2+2Cl© ClŗĶBr¾łĪŖµŚ¢÷A×åŌŖĖŲ£¬Ō×Ó×īĶā²ćµē×ÓŹż¾łĪŖ7£¬µē×Ó²ćŹżCl£¼Br£¬Ō×Ó°ė¾¶Cl£¼Br£¬µĆµē×ÓÄÜĮ¦Cl£¾Br£¬·Ē½šŹōŠŌCl£¾Br b 5Br©+BrO3©+6H+ØT3Br2+3H2O
”¾½āĪö”æ
(1)Cl2ŗĶæąĀ±ÖŠµÄBr-·“Ӧɜ³ÉBr2£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗCl2+2Br-=Br2+2Cl-£»
(2)ClŗĶBr¾łĪŖµŚ¢÷A×åŌŖĖŲ£¬Ō×Ó×īĶā²ćµē×ÓŹż¾łĪŖ7£¬ÓÉÓŚµē×Ó²ćŹżCl£¼Br£¬Ō×Ó°ė¾¶Cl£¼Br£¬ĖłŅŌµĆµē×ÓÄÜĮ¦Cl£¾Br£¬ŌŖĖŲ·Ē½šŹōŠŌ£ŗCl£¾Br£»
(3)ĪüŹÕĖžÖŠ£¬AĪüŹÕĮĖBr2ŗóµÄČÜŅŗÖŠŗ¬ÓŠBr-ŗĶBrO3-£¬ĖµĆ÷äåµ„ÖŹŌŚ¼īČÜŅŗÖŠ·“Ӧɜ³ÉĮĖBr-ŗĶBrO3-£¬Ń”b£»
(4)“ÓĪüŹÕĖž³öĄ“µÄČÜŅŗÖŠ¼ÓČėĻ”H2SO4µĆµ½Br2µÄĄė×Ó·½³ĢŹ½ŹĒ£ŗ5Br-+BrO3-+6H+=3Br2+3H2O”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æµ°°×ÖŹŹĒ¹¹³ÉÉśĪļĢåÄŚµÄ»ł±¾ĪļÖŹ£¬µ°°×ÖŹµÄ×é³ÉŌŖĖŲÖ÷ŅŖÓŠĒā”¢Ģ¼”¢µŖ”¢Ńõ”¢Įņ£¬Ķ¬Ź±»¹ÓŠĪ¢ĮæŌŖĖŲĢś”¢ŠæµČ”£»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)Ģ¼”¢µŖ”¢ŃõČżŌŖĖŲµÄµŚŅ»µēĄėÄÜÓÉŠ”µ½“óµÄĖ³ŠņĪŖ________________(ÓĆŌŖĖŲ·ūŗűķŹ¾)£»
(2)N3£µÄĮ¢Ģå¹¹ŠĶŹĒ___________ŠĪ£ŗÓėN3£»„ĪŖµČµē×ÓĢåµÄŅ»ÖÖ·Ö×ÓŹĒ___________(Ģī·Ö×ÓŹ½)”£
(3)½«×ćĮæµÄ°±Ė®ÖšµĪµŲ¼ÓČėµ½ZnSO4ČÜŅŗÖŠ£¬ĻČÉś³É³Įµķ£¬Č»ŗó³ĮµķČܽāÉś³ÉÅäŗĻĪļ[Cu(NH3)4SO4£¬ÅäĪ»»ÆŗĻĪļÖŠµÄŃōĄė×Ó½į¹¹Ź½ĪŖ___________£»SO42£ÖŠµÄĮņŌ×ÓŌӻƷ½Ź½ĪŖ___________£»ÓĆ¼Ū²ćµē×Ó¶Ō»„³āĄķĀŪ½āŹĶSO42£µÄ¼ü½Ē“óÓŚSO32£µÄŌŅņŹĒ_________________________________”£
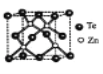
(4)ķŚ»ÆŠæ¾§ĢåÓŠĮ½ÖÖ½į¹¹£¬ĘäÖŠŅ»ÖÖ¾§°ū½į¹¹ČēĻĀĶ¼£¬¾§°ūÖŠÓėZnŌ×Ó¾ąĄė×ī½üµÄTeŌ×ÓĪ§³É____ĢåĶ¼ŠĪ£»ÓėTeŌ×Ó¾ąĄė×ī½üµÄTeŌ×ÓÓŠ___øö£»ČōZnÓė¾ąĄė×ī½üµÄTeŌ×Ó¼ä¾ąĪŖapm£¬Ōņ¾§ĢåĆܶČĪŖ____g/cm3”£
(ŅŃÖŖĻą¶ŌŌ×ÓÖŹĮæ£ŗZn-65”¢Te-128)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ·“Ó¦·½³ĢŹ½ŹéŠ“²»ÕżČ·µÄŹĒ
A. ÓĆĒā·śĖįµńæĢ²£Į§£ŗSiO2+4HF=SiF4”ü+2H2O
B. ¹¤ŅµÉĻÓƵē½ā·ØÖĘĆ¾£ŗMgCl2(ČŪČŚ) ![]() Mg+Cl2”ü
Mg+Cl2ӟ
C. ½«ĀĮʬ“ņÄ„ŗó·ÅČėĒāŃõ»ÆÄĘČÜŅŗÖŠ£ŗ2Al+2OH©=2AlO2-+H2”ü
D. ĒāŃõ»ÆŃĒĢś±©Ā¶ÓŚæÕĘųÖŠ£ŗ4Fe(OH)2 +O2 +2H2O=4Fe(OH)3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚÓĶÖ¬ŗĶŅŅĖįŅŅõ„µÄ±Č½ĻÕżČ·µÄŹĒ£Ø £©
A.ÓĶÖ¬ŗĶŅŅĖįŅŅõ„¶¼ŹĒ“æ¾»Īļ£¬ŌŚŹŅĪĀĻĀ¶¼ŹĒŅŗĢå
B.ÓĶÖ¬ŗĶŅŅĖįŅŅõ„ŌŚ¼īŠŌĢõ¼žĻĀµÄĖ®½ā·“Ó¦¶¼ŹĒŌķ»Æ·“Ó¦
C.ŅŅĖįŅŅõ„ŗĶÓĶÖ¬¶¼ÓŠ¹ūĻćĪ¶£¬ŅŅĖįŅŅõ„ŹĒŅ»ÖÖĢŲŹāµÄÓĶÖ¬
D.ÓĶÖ¬ŗĶŅŅĖįŅŅõ„¶¼ÄŃČÜÓŚĖ®£¬¶ųŅ×ČÜÓŚÓŠ»śČܼĮ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÓŠ¹ŲÓŠ»śĪļĖ®½āµÄĖµ·ØÕżČ·µÄŹĒ£Ø £©
A.ĻĖĪ¬ĖŲĖ®½āµÄ×īÖÕ²śĪļŹĒĘĻĢŃĢĒB.µ°°×ÖŹĖ®½āµÄ×īÖÕ²śĪļŹĒ¶ąėÄ
C.ÓĶÖ¬µÄĖ®½ā·“Ó¦¾ĶŹĒŌķ»Æ·“Ó¦D.ÓŠ»śĪļÓėĖ®µÄ·“Ó¦¶¼ŹĒĖ®½ā·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĖ®µÄµēĄėĘ½ŗāĒśĻßČēĶ¼ĖłŹ¾”£

£Ø1£©ČōŅŌAµć±ķŹ¾25 ”ꏱĖ®ŌŚµēĄėĘ½ŗāŹ±µÄĄė×ÓÅØ¶Č£¬µ±ĪĀ¶ČÉżµ½100 ”ꏱ£¬Ė®µÄµēĄėĘ½ŗāדĢ¬µ½Bµć£¬Ōņ100 ”ꏱ£¬Ė®µÄĄė×Ó»żĪŖ______________”£
£Ø2£©³£ĪĀĻĀ£¬½«pH£½10µÄBa(OH)2ČÜŅŗÓėpH£½5µÄĻ”ŃĪĖį»ģŗĻ£¬Č»ŗó±£³Ö100 ”ęµÄŗćĪĀ£¬ÓūŹ¹»ģŗĻČÜŅŗpH£½7£¬ŌņBa(OH)2ÓėŃĪĖįµÄĢå»ż±ČĪŖ_______________________”£
£Ø3£©25 ”ꏱ£¬ĻņĖ®ÖŠ¼ÓČėÉŁĮæĢ¼ĖįÄĘ¹ĢĢ壬µĆµ½pHĪŖ11µÄČÜŅŗ£¬ĘäĖ®½āµÄĄė×Ó·½³ĢŹ½ĪŖ_________________________£¬ÓÉĖ®µēĄė³öµÄc(OH£)£½_______________mol”¤L£1”£
£Ø4£©µČĢå»żµÄĻĀĮŠČÜŅŗÖŠ£¬ŅõĄė×ÓµÄ×ÜĪļÖŹµÄĮæ×ī“óµÄŹĒ_____________(ĢīŠņŗÅ)”£
¢Ł0.1 mol”¤L£1µÄCuSO4ČÜŅŗ ¢Ś0.1 mol”¤L£1µÄNa2CO3
¢Ū0.1 mol”¤L£1µÄKCl ¢Ü0.1 mol”¤L£1µÄNaHCO3
£Ø5£©Ä³¶žŌŖĖį(»ÆѧŹ½ÓĆH2A±ķŹ¾)ŌŚĖ®ÖŠµÄµēĄė·½³ĢŹ½ŹĒ£ŗH2A===H£«£«HA££¬HA£H£«£«A2£”£
¢ŁŌņNa2AČÜŅŗĻŌ__________(Ģī”°ĖįŠŌ”±”°ÖŠŠŌ”±»ņ”°¼īŠŌ”±)£»NaHAČÜŅŗĻŌ__________(Ģī”°ĖįŠŌ”±”°ÖŠŠŌ”±»ņ”°¼īŠŌ”±)”£
¢ŚĻÖÓŠ0.1 mol”¤L£1 Na2AµÄČÜŅŗ£¬ĘäÖŠø÷ÖÖĪ¢Į£ÅØ¶Č¹ŲĻµÕżČ·µÄŹĒ__________(Ģī×ÖÄø)”£
A£®c(Na£«)>c(A2£)>c(OH£)>c(HA£)
B£®c(Na£«)=2c(HA£)+2c((A2£)+2c(H2A)
C£®c(Na£«)+c(H£«)=c(HA£)+c(A2£)+c(OH£)
D£®c(OH£)=c(HA£)+c(H£«)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ»ÆŗĻĪļÖŠ£¬¼Čŗ¬ÓŠ¼«ŠŌ¼üÓÖŗ¬ÓŠ·Ē¼«ŠŌ¼üµÄŹĒ£Ø £©
A. Na2O2B. H2O2C. CH4D. NH4Cl
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĶ¬Ń§ÓĆĶ¼ĖłŹ¾µÄ×°ÖĆ¼°Ņ©Ę·½ųŠŠĖįŠŌĒæČõ±Č½ĻµÄŹµŃ飬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ

A. ¢ŁŗĶ¢ŚÖŠ·¢ÉśµÄ·“Ó¦¾łĪŖŃõ»Æ»¹Ō·“Ó¦
B. ĻņNa2SiO3±„ŗĶČÜŅŗÖŠµĪ·ÓĢŖČÜŅŗĪŽĆ÷ĻŌĻÖĻó
C. Ņ»¶ĪŹ±¼äŗó¢ŚÖŠÓŠ½ŗ¶³×“ĪļÖŹÉś³É
D. øĆŹµŃéÄÜÖ¤Ć÷ĖįŠŌĒæČõµÄĖ³ŠņŹĒ£ŗĢ¼Ėį£¾ĮņĖį£¾¹čĖį
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČēĶ¼ŹĒŗćĪĀĢõ¼žĻĀij»Æѧ·“Ó¦µÄ·“Ó¦ĖŁĀŹĖę·“Ó¦Ź±¼ä±ä»ÆµÄŹ¾ŅāĶ¼”£ĻĀĮŠŠšŹöÓėŹ¾ŅāĶ¼²»Ļą·ūŗĻµÄŹĒ

A. ·“Ó¦“ļµ½Ę½ŗāŹ±£¬Õż·“Ó¦ĖŁĀŹŗĶÄę·“Ó¦ĖŁĀŹĻąµČ
B. øĆ·“Ó¦“ļµ½Ę½ŗāדĢ¬¢ńŗó£¬Ōö“óĢåĻµŃ¹Ēæ£¬Ę½ŗā·¢ÉśŅĘ¶Æ£¬“ļµ½Ę½ŗāדĢ¬¢ņ
C. øĆ·“Ó¦“ļµ½Ę½ŗāדĢ¬¢ńŗó£¬Ōö“ó·“Ó¦ĪļÅØ¶Č£¬Ę½ŗā·¢ÉśŅĘ¶Æ£¬“ļµ½Ę½ŗāדĢ¬¢ņ
D. Ķ¬Ņ»ÖÖ·“Ó¦ĪļŌŚĘ½ŗāדĢ¬¢ńŗĶĘ½ŗāדĢ¬¢ņŹ±ÅØ¶Č²»ĻąµČ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com