
| “߻ƼĮ |
| ”÷ |
| “߻ƼĮ |
| ”÷ |
| “߻ƼĮ |
| ”÷ |
| “߻ƼĮ |
| ”÷ |


 ČżµćŅ»²āæģĄÖÖÜ¼Ę»®ĻµĮŠ“š°ø
ČżµćŅ»²āæģĄÖÖÜ¼Ę»®ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
 £Ø2013?½Ī÷Ä£Äā£©£ØŅ»£©X”¢Y”¢Z”¢L”¢MĪåÖÖŌŖĖŲµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó£¬XµÄŅõĄė×ÓÓėYµÄÄŚ²ćµē×ÓŹżĻąµČ£¬YŌ×ÓµÄ×īĶā²ćµē×ÓŹżŹĒ“ĪĶā²ćµē×ÓŹżµÄĮ½±¶£¬Z”¢LŹĒæÕĘųÖŠŗ¬Įæ×ī¶ąµÄ¶žÖÖŌŖĖŲ£¬MŹĒµŲæĒÖŠŗ¬Įæ×īøߵĽšŹōŌŖĖŲ£®»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø2013?½Ī÷Ä£Äā£©£ØŅ»£©X”¢Y”¢Z”¢L”¢MĪåÖÖŌŖĖŲµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó£¬XµÄŅõĄė×ÓÓėYµÄÄŚ²ćµē×ÓŹżĻąµČ£¬YŌ×ÓµÄ×īĶā²ćµē×ÓŹżŹĒ“ĪĶā²ćµē×ÓŹżµÄĮ½±¶£¬Z”¢LŹĒæÕĘųÖŠŗ¬Įæ×ī¶ąµÄ¶žÖÖŌŖĖŲ£¬MŹĒµŲæĒÖŠŗ¬Įæ×īøߵĽšŹōŌŖĖŲ£®»Ų“šĻĀĮŠĪŹĢā£ŗ ”ś
”ś
 ”ś
”ś


²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
 £Ø1£©ŌŚŅ»ÉÕ±ÖŠŹ¢ÓŠĻ”H2SO4 ČÜŅŗ£¬Ķ¬Ź±ÓŠŅ»±ķĆę¹ā»¬µÄĖÜĮĻŠ”ĒņŠüø”ÓŚČÜŅŗÖŠŃė£¬£ØČēĶ¼£©£®ĻņøĆÉÕ±Ąļ»ŗ»ŗ×¢ČėÓėĻ”H2SO4 µČĆܶȵÄBa£ØOH£©2 ČÜŅŗÖĮĒ”ŗĆĶźČ«·“Ó¦£®ŌņŌŚ“ĖŹµŃé¹ż³ĢÖŠ£ŗ¢ŁÉÕ±Ąļ¹Ū²ģµ½µÄĻÖĻóĪŖ
£Ø1£©ŌŚŅ»ÉÕ±ÖŠŹ¢ÓŠĻ”H2SO4 ČÜŅŗ£¬Ķ¬Ź±ÓŠŅ»±ķĆę¹ā»¬µÄĖÜĮĻŠ”ĒņŠüø”ÓŚČÜŅŗÖŠŃė£¬£ØČēĶ¼£©£®ĻņøĆÉÕ±Ąļ»ŗ»ŗ×¢ČėÓėĻ”H2SO4 µČĆܶȵÄBa£ØOH£©2 ČÜŅŗÖĮĒ”ŗĆĶźČ«·“Ó¦£®ŌņŌŚ“ĖŹµŃé¹ż³ĢÖŠ£ŗ¢ŁÉÕ±Ąļ¹Ū²ģµ½µÄĻÖĻóĪŖ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
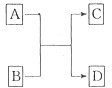
 A”¢B”¢C”¢D·Ö±šŹĒHNO3”¢Ba£ØNO3£©2”¢NH4Cl”¢NaOHĖÄÖÖČÜŅŗÖŠµÄŅ»ÖÖ£®ĻÖĄūÓĆĮķŅ»ÖÖ³£¼ūČÜŅŗX£¬ÓĆĻĀĶ¼ĖłŹ¾µÄ·½·Ø£¬æɽ«ĖüĆĒŅ»Ņ»Č·¶Ø£®Ēė»Ų“šŅŌĻĀĪŹĢā£ŗ
A”¢B”¢C”¢D·Ö±šŹĒHNO3”¢Ba£ØNO3£©2”¢NH4Cl”¢NaOHĖÄÖÖČÜŅŗÖŠµÄŅ»ÖÖ£®ĻÖĄūÓĆĮķŅ»ÖÖ³£¼ūČÜŅŗX£¬ÓĆĻĀĶ¼ĖłŹ¾µÄ·½·Ø£¬æɽ«ĖüĆĒŅ»Ņ»Č·¶Ø£®Ēė»Ų“šŅŌĻĀĪŹĢā£ŗ

| µē½āÖŹ | HF | HCOOH | CH3COOH | HCN | NH3?H2O |
| µēĄė¶Č | 8.00% | 7.16% | 1.32% | 0.01% | 1.33% |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com